⇒ Oxydation périphérique du glucose (figure 4)
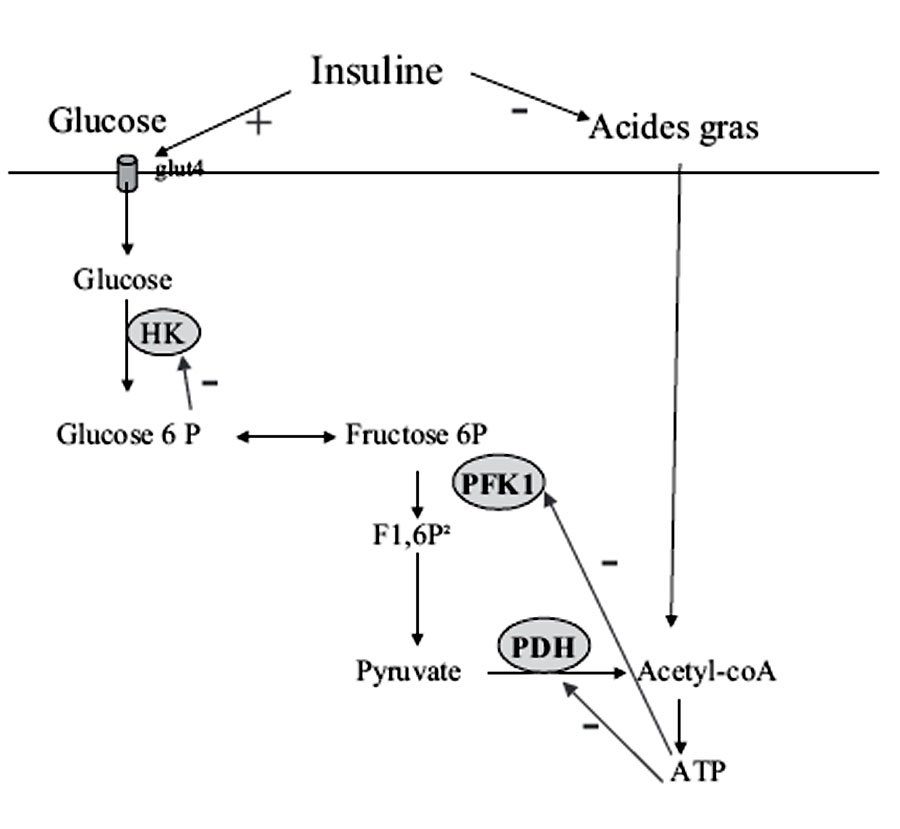
Après charge orale de glucose, le débit d’oxydation maximal, quelle que soit la quantité de glucose ingéré, est de 4 mg/kg/min ; cette augmentation est liée à l’oxydation du glucose au niveau des tissus insulino-dépendants (muscles) grâce à la présence d’insuline. Celle-ci agit par deux mécanismes.
- Elle augmente la pénétration du glucose par activation du GLUT4, transporteur du glucose qui migre sur la membrane (translocation) sous l’effet de l’insuline.
- Elle inhibe la lipolyse, diminuant ainsi la disponibilité en acides gras libres.
Le contrôle de l’oxydation du glucose dépend de 3 enzymes : enzymatiques sont régulés par la production d’ATP intra-cellulaire (PFK1 et PDH), ou par le G6P (HK). Lorsque les acides gras sont oxydés, la production d’ATP qui en résulte va donc inhiber la PFK1 et la PDH et l’augmentation du G6P qui en résulte inhibe l’hexokinase.
En présence d’une augmentation de la disponibilité en acides gras (obésité), la compétition entre les substrats diminue l’oxydation du glucose, même en présence d’insuline.
⇒ Stockage du glucose
La forme de stockage du glucose est principalement le glycogène. La lipogenèse à partir du glucose (lipogénèse de novo) est minime dans les conditions physiologiques.
Glycogène
Le glycogène est stocké dans le foie et dans le muscle. Les réserves de l’organisme en glycogène sont, en fait, très limitées (70 g dans le foie, 150-300 g dans le muscle). La synthèse du glycogène dans le foie peut être réalisée selon la voie directe : Glucose – Glucose 6P – Glucose 1P – UDP glucose – Glycogène. Le métabolisme du glycogène est contrôlé par la glycogène-phosphorylase et le glycogène synthétase. Dans le foie, le glucose associé à l’insuline est le principal élément régulateur.
Dans le muscle, l’insuline stimule la synthèse du glycogène en activant la glycogène synthétase. Cette action de l’insuline est ici indépendante de la présence du glucose.
Lipogénèse
La biosynthèse des acides gras est réalisée à partir de l’acétyl CoA dans le foie et dans le tissu adipeux. Chez l’homme, il est plus probable que la lipogenèse d’origine glucidique soit principalement hépatique, le tissu adipeux servant surtout au stockage des triglycérides. En fait, la lipogenèse à partir du glucose n’est observée in vivo qu’en cas d’alimentation très riche en glucides et d’hyperinsulinisme
2 . 2 - Métabolisme postprandial des lipides (figure 5)
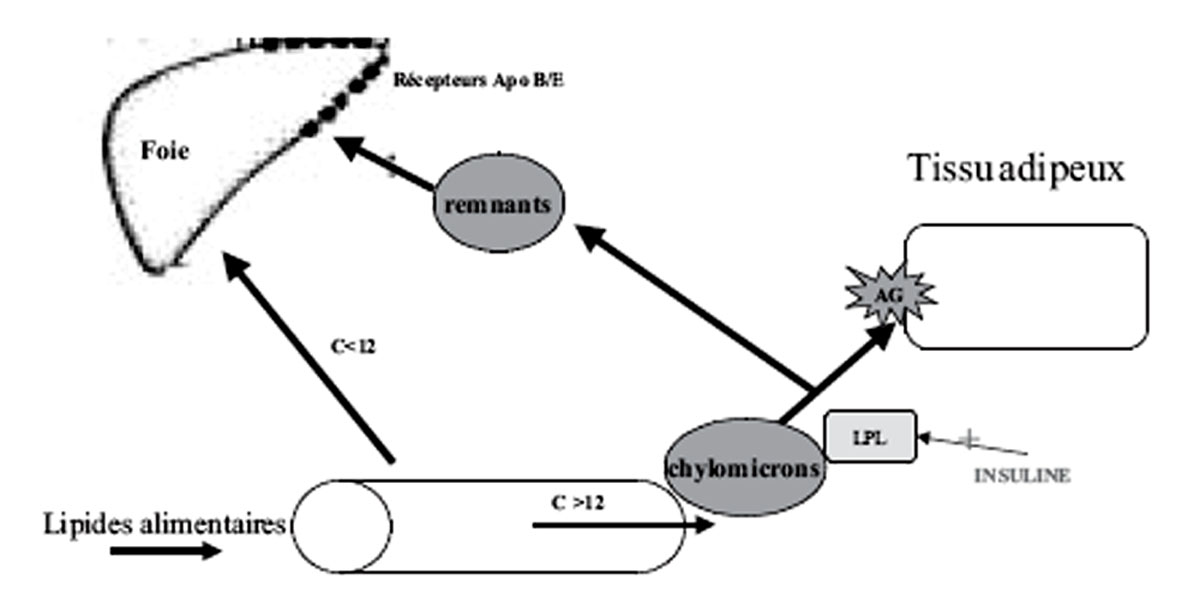
- Les lipides du repas sont essentiellement constitués de triglycérides.
- Ils sont hydrolysés dans la lumière intestinale puis, après absorption dans les entérocytes, réestérifiés avec des aporotéines B48 et A1 pour former des chylomicrons.
- Les chylomicrons, contrairement aux autres substrats entrent dans la circulation par le canal thoracique et sont captés essentiellement par le tissu adipeux grâce à la lipo-rotéine lipase, activée par l’insuline. Seuls les acides gras à chaîne courte passent par la veine porte.
- Cette hydrolyse des acides gras, associée à un enrichissement en apo E, transforme les chylomicrons en remnants qui sont captés par le foie grâce à des récepteurs de
- l’apoE et de l’apo B. Ainsi en période post prandiale, les lipides ingérés sont directement orientés vers le stockage au niveau du tissu adipeux.
2 . 3 - Métabolisme postprandial des protéines
Les acides aminés arrivant au foie sont :
- Oxydés par désamination.
- Utilisés in situ pour la synthèse des protéines hépatiques.
- Passent dans le sang pour être captés par les tissus périphériques.