- Pré-requis et Objectifs
- Cours
- Annexes
- Votre Avis
- Ressources Enseignants
2 - Identifier les situations d'urgence et planifier leur prise en charge
Les complications graves de la cirrhose qui constituent potentiellement une menace vitale et justifient une prise en charge dans un contexte d’urgence sont les hémorragies digestives liées à l’hypertension portale, l’encéphalopathie, l’infection du liquide d’ascite et le syndrome hépatorénal.
2 . 1 - Hémorragies digestives par rupture de varices oesophagiennes et/ou gastriques
Les ulcères gastro-duodénaux ne sont pas spécifiques de la cirrhose et sont traités dans un autre chapitre. La gastropathie d’hypertension portale peut conduire à une anémie chronique mais jamais à une hémorragie aiguë.
1. Diagnostic et appréciation de la gravité
L’hémorragie digestive par rupture de varices oesophagiennes se manifeste par une hématémèse et/ou un melaena, associés à une anémie aiguë (diminution du taux d’hémoglobine). L’examen montre une pâleur cutanée et muqueuse. Il existe également une tachycardie. L’absence de tachycardie suggère la prise de bêta-bloquants. En cas d’hémorragie massive, il peut exister une hypotension voire un état de choc avec des marbrures. En l’absence d’extériorisation du saignement, on doit chercher le melaena par un toucher rectal.
La gravité de l’hémorragie est estimée par la baisse de la pression artérielle, la tachycardie, l’augmentation de la fréquence respiratoire et les troubles de la conscience. L’hématocrite mesuré très précocement (lors de la prise en charge au domicile par exemple) peut sous-estimer la gravité de l’hémorragie.
Si le diagnostic de cirrhose est connu, rattacher l’hémorragie digestive à une rupture de varices est aisé et sera confirmé rapidement par la réalisation d’une endoscopie digestive haute (qui éliminera un ulcère hémorragique ou redressera le diagnostic). En cas d’hémorragie digestive révélatrice, la recherche de signes anamnestiques (contexte), cliniques et biologiques (cf. supra) de cirrhose fait partie du bilan initial de toute hémorragie digestive.
2. Prise en charge d’une hémorragie digestive
liée à l’hypertension portale
a. Mesures générales
Les malades cirrhotiques qui ont une hémorragie digestive haute doivent être transférés dans une unité de soins intensifs ou de réanimation.
En cas d’hypotension sévère ou de choc, la première étape de la prise en charge consiste à poser une ou deux voies veineuses périphériques de bon calibre puis à effectuer un remplissage vasculaire avec comme objectif d’obtenir une pression artérielle moyenne aux alentours de 80 mmHg. Un remplissage vasculaire excessif augmente la pression portale et favorise les récidives hémorragiques. On peut utiliser soit des cristalloïdes (sérum salé par exemple) soit des colloïdes. En parallèle, on doit réaliser des examens biologiques incluant une numération formule sanguine et la détermination du groupe sanguin.
Une transfusion est justifiée en cas de mauvaise tolérance de l’anémie ou si l’hématocrite est inférieur à 25 % et/ou si le taux d’hémoglobine est inférieur à 7 g/dL. L’objectif de la transfusion est d’obtenir un hématocrite entre 25 et 30 % et un taux d’hémoglobine supérieur à 7 g/dL.
Il est recommandé de mettre en place une sonde nasogastrique. Elle a pour objectif de vérifier la présence de sang dans l’estomac lorsque les patients n’ont pas eu d’hématémèse, de vider le contenu de l’estomac pour prévenir le risque d’inhalation et de chercher un saignement persistant, dans les heures qui suivent l’admission.
La prise en charge doit être celle d’une hémorragie en rapport avec l’hypertension portale. Dans la plupart des cas, l’hémorragie s’est interrompue spontanément au moment de la prise en charge. L’objectif est alors de prévenir la récidive précoce qui, en l’absence de traitement spécifique, est fréquente.
La correction des troubles de l’hémostase par des transfusions de plasma frais congelé ou d’autres produits dérivés du sang n’est pas recommandée.
b. Traitement vaso-actif
Un traitement vaso-actif destiné à réduire la pression portale doit être institué en urgence. Ce traitement repose sur l’administration intraveineuse soit de somatostatine ou d’analogues de la somatostatine (octréotide) soit de dérivés de la vasopressine (terlipressine). Les modalités d’administration sont les suivantes :
– somatostatine : bolus de 250 μg suivi d’une perfusion continue de 250 μg/heure ;
– octréotide : bolus de 50 μg suivi d’une perfusion continue de 25 μg/heure ;
– terlipressine : 1 mg toutes les 4 heures en injection intraveineuse lente.
La terlipressine est associée à un risque plus élevé de complications liées à une vasoconstriction artérielle périphérique. La terlipressine est contre-indiquée chez les malades ayant une coronaropathie et/ou une artériopathie oblitérante des membres inférieurs.
Ce traitement doit être administré entre 2 et 5 jours après l’admission. Au-delà de cette phase précoce, un relais doit être pris par des bêta-bloquants au long cours.
c. Antibioprophylaxie
Les épisodes d’hémorragie digestive par rupture de varices oesophagiennes chez les patients cirrhotiques se compliquent fréquemment d’une infection bactérienne. Les infections bactériennes aggravent le pronostic. Une antibioprophylaxie systématique réduit significativement la mortalité. Elle repose sur une fluoroquinolone ou l’amoxicilline-acide clavulanique pour une durée de 7 jours.
d. Endoscopie
Une endoscopie digestive haute est indispensable pour établir la cause du saignement (fig. 19.4). L’endoscopie a d’autant plus de chances d’établir le diagnostic qu’elle est réalisée dans de bonnes conditions. Le saignement digestif limite la visibilité. Une préparation reposant soit sur un lavage gastrique soit sur l’administration préalable d’érythromycine (250 mg) par voie intraveineuse 30 à 60 minutes avant l’endoscopie (traitement qui déclenche une vidange accélérée de l’estomac) est nécessaire. Dans tous les cas, en l’absence d’hémorragie active, il est préférable de réaliser l’endoscopie dans des conditions optimales plutôt que dans un contexte d’urgence, sans préparation, avec une visibilité limitée et une faible rentabilité.
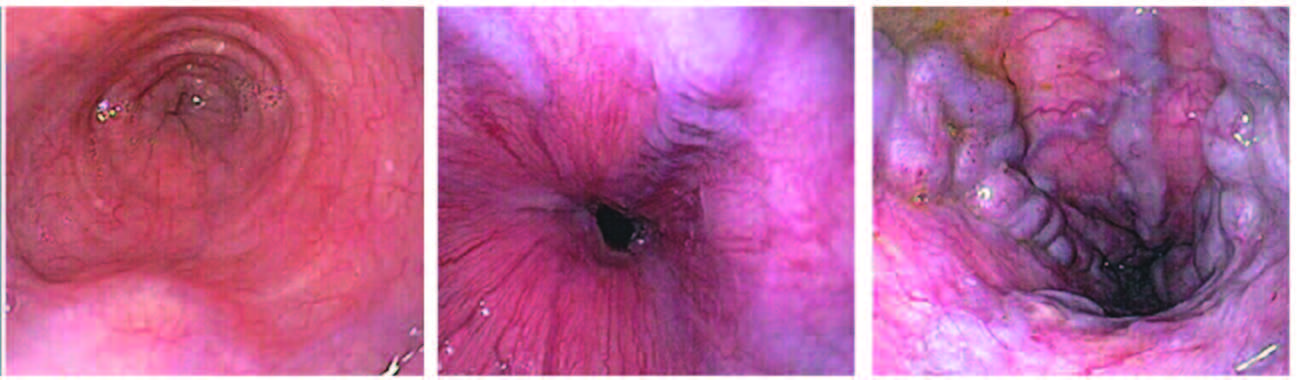
L’endoscopie peut être diagnostique (visualisation des varices oesophagiennes, d’une hémorragie active ou d’un clou plaquettaire adhérant à une varice comme témoin d’une hémorragie récente) ou thérapeutique, permettant l’arrêt d’une hémorragie active (voir paragraphe ci dessous). Si l’hémorragie est contrôlée, elle permet également de réaliser des ligatures endoscopiques des varices, afin de réduire le risque de récidive.
Fig. 19.4. Aspect des varices oesophagiennes en endoscopie (A : absence de varices ; B : petites varices de grade I ; C : grosses varices de grade III)
e. Cas particulier de l’hémorragie active
Dans les premières heures qui suivent l’hémorragie, la présence de sang dans la sonde gastrique tout comme la persistance de sang lors de lavages gastriques répétés ne sont pas synonymes d’hémorragie active. Il peut s’agir de sang et/ou de caillots résiduels. Seules l’inefficacité des transfusions de concentrés globulaires et l’hypotension persistante (impossibilité d’augmenter la pression artérielle systolique de 20 mmHg ou au-dessus de 70 mmHg) traduisent le caractère actif de l’hémorragie.
L’hémostase peut être obtenue par une geste endoscopique (ligature élastique de la varice qui saigne activement) en sachant que l’endoscopie dans un contexte d’hémorragie active est limitée par une mauvaise visibilité et que le saignement peut être difficile à localiser.
En cas d’échec de l’endoscopie, on peut avoir recours soit à une sonde de tamponnement oesophagien (sonde de Blakemore), soit à la mise en place en urgence d’un shunt porto-cave intrahépatique par voie transjugulaire (TIPS pour transjugular intrahepatic portosystemic shunt). Cette prothèse vasculaire ne peut être mise en place que dans un centre spécialisé.
Dans cette situation, la mortalité est élevée. En l’absence de traitement préventif, le taux de récidive précoce après un épisode d’hémorragie digestive par rupture de varices oesophagiennes est de 60 à 90 %. En l’absence de traitement spécifique, la mortalité liée l’hémorragie est de 30 à 50 %. Le taux de mortalité a diminué au cours des dernières années en raison d’une amélioration de la prise en charge (15-20 % au cours des dernières années contre 30 % dans les années 80).
2/5