4 . 2 . 1 - Hyperparathyroïdie primaire (HPT1)
L’incidence de l’HPT1 était de 7,8/100 000 en 1970 ; elle est maintenant de 27/ 100 000, vraisemblablement du fait de l’exploration systématique en routine du métabolisme phosphocalcique.
La dénomination d’hyperparathyroïdie primaire regroupe les hyperparathyroïdies liées à une lésion initiale parathyroïdienne, responsable d’une sécrétion autonome de PTH, elle-même responsable des altérations du métabolisme phosphocalcique et de ses conséquences sur le tissu osseux, dont la résultante la plus caractéristique est l’hypercalcémie.
4 . 2 . 1 . 1 - Signes cliniques
Les signes cliniques qui évoquent le diagnostic sont ceux qui figurent dans le tableau 20.I ; ils ne font qu’indiquer l’existence de l’hypercalcémie, et traduisent une hypercalcémie franche, en règle générale supérieure à 3 mmol/L.
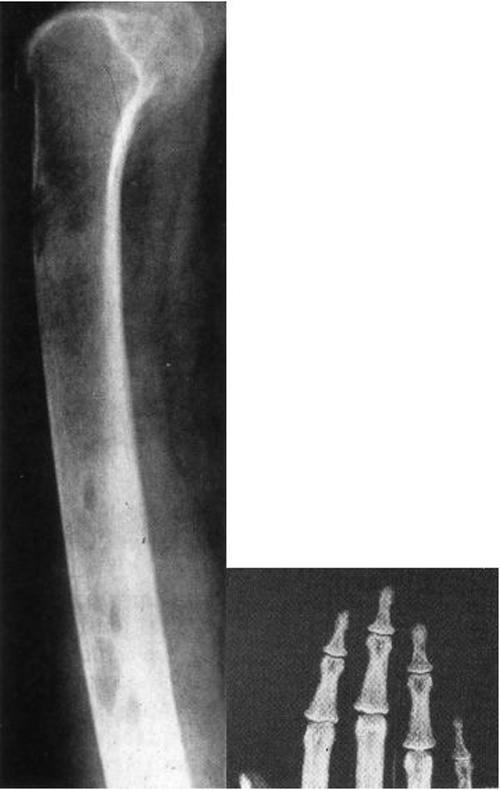
S’y ajoutent des signes osseux cliniques et radiologiques (figure 20.2 et tableau 20.II), dont l’ostéite fibrokystique de von Recklinhausen qui représente la forme historique, actuellement exceptionnelle.
Ces signes osseux (cliniques ou radiologiques) sont le reflet d’un déséquilibre du remodelage osseux au profit de la résorption ostéoclastique, dont le meilleur témoin est la mesure de la baisse de la densité osseuse, d’autant plus évidente que le terrain est prédisposé (femme ménopausée, en particulier). Les signes osseux cliniques et radiologiques sont rarement présents dans les formes actuelles des HPT1, de découverte fortuite dans plus de 80 % des cas sur la seule constatation d’une hypercalcémie, et c’est donc l’étude de la densité osseuse qui permet le mieux de quantifier le retentissement osseux des HPT1 (+++). L’étude de la densité osseuse, évaluée au moyen du T-score, fait partie des éléments décisionnels pour l’orientation thérapeutique des HPT1. L’existence de signes cliniques, surtout s’il s’agit de signes osseux, traduit un processus pathologique déjà ancien.
| Signes cliniques | Douleurs osseuses calmées par le repos Tuméfactions Fractures pathologiques « spontanées » |
| Signes radiologiques | Voûte crânienne : ostéoporose granuleuse Mâchoires : disparition des lamina dura Mains : résorption des houppes phalangiennes Bassin-fémurs : stries de Looser-Milkmann Tassements vertébraux Ostéite fibrokystique |
| Diminution de la densité osseuse | +++ |
4 . 2 . 1 . 2 - Biologie
Il existe une relation étroite entre les valeurs de la calcémie totale ou ionisée et celles de la PTH plasmatique : le diagnostic biologique de l’HPT1 est défini par l’association hypercalcémie et PTH plasmatique élevée ou « normale » mais en discordance avec l’hypercalcémie.
Hypercalcémie
Le diagnostic d’HPT1 a toujours reposé, et repose encore, sur la constatation d’une hypercalcémie.
La première étape consiste à répéter les dosages de la calcémie pour confirmer l’existence de l’hypercalcémie, qui est constante dans l’HPT1. Dans les formes frustes ou débutantes, il peut y avoir dans le temps une alternance d’hyper et de normocalcémies : ces fluctuations biologiques transitoires peuvent persister plusieurs mois (ou années) et ont pu faire évoquer l’existence d’« hyperparathyroïdies normocalcémiques », dont la réalité reste discutable.
Une hypovitaminose D, une hypoalbuminémie ou une acidose peuvent masquer l’hypercalcémie d’une HPT ; dans ces cas (comme dans les formes typiques), le calcium ionisé plasmatique est élevé bien que la calcémie totale puisse être normale ou non significativement augmentée.
Dosage plasmatique de la parathormone (+++)
La PTH est sécrétée sous la forme d’un peptide de 84 AA. Les dosages actuels immunométriques permettent de mesurer la PTH(1-84)ou ses fragments biologiquement actifs. Avec ces dosages, toute coexistence d’une hypercalcémie même mineure et d’une valeur élevée ou inappropriée (ou « anormalement normale ») de la PTH induit le diagnostic biologique d’HPT1, à l’exception du diagnostic différentiel avec le syndrome d’hypercalcémie-hypocalciurie familiale (cf. infra). Il faut impérativement comparer les chiffres de la PTH à ceux de la calcémie et ne pas oublier qu’une hyperparathormonémie est un mécanisme physiologique d’adaptation à une baisse de la calcémie, due à une anomalie de l’absorption (par exemple, carence en vitamine D) ou de l’élimination rénale calcique (par exemple, protéinurie). A contrario, une hypercalcémie associée à des valeurs basses de PTH doit faire évoquer une étiologie non dépendante d’une HPT1 : métastases ostéolytiques, sarcoïdose ou syndrome paranéoplasique avec sécrétion de PTHrp, ou autre facteur.
Autres paramètres biologiques
Phosphorémie
L’hyperparathyroïdie augmente la clairance du phosphate en diminuant sa réabsorption tubulaire, d’où l’hypophosphorémie, qui est en règle générale bien corrélée à l’hypercalcémie.
Cependant, la phosphorémie varie de façon importante en fonction de l’apport nutritionnel (et donc de l’instant où est effectué le prélèvement) et de la fonction rénale. L’hypophosphorémie n’est en fait retrouvée que dans 50 % des cas.
Il faut insister sur le fait que les calcémies et phosphorémies ne peuvent être valablement interprétées pour le diagnostic d’HPT1 que si la fonction rénale est normale.
Calciurie
Elle est augmentée dans l’HPT1 du fait de l’augmentation du calcium complexé ultrafiltrable non réabsorbable, et ce malgré l’augmentation de la réabsorption tubulaire du calcium ionisé par l’action de la PTH sur le tubule rénal.
Cependant, les variations physiologiques de la calciurie sont trop importantes pour que ce paramètre soit fiable. Il ne sera utile que pour faire un diagnostic différentiel entre une forme fruste d’HPT1 et le syndrome hypercalcémie-hypocalciurie familiale (+++).
4 . 2 . 1 . 3 - Imagerie
Toutes les techniques utilisées actuellement ont l’avantage d’être non invasives. Elles visent à mettre en évidence un adénome parathyroïdien, dans le seul but d’orienter le geste opératoire. Les plus couramment utilisées et les plus performantes sont l’échographie (60 à 80 % de détection) et la scintigraphie au SestaMIBI (cf. chapitre 1 : « Indications et stratégies d’utilisation des principaux examens d’imagerie ») (85 % de détection), avec quasiment 100 % de valeur de localisation d’un adénome lorsque ces deux imageries sont concordantes en présence d’un diagnostic biologique.
Toutefois, en aucun cas les résultats de l’imagerie ne doivent interférer dans le diagnostic positif de l’HPT1, qui reste un diagnostic biologique. Une imagerie positive ne doit pas influencer un diagnostic litigieux sur le plan biologique, de même une imagerie négative ne doit pas remettre en question un diagnostic biologique certain. L’imagerie préopératoire actuelle n’est qu’un procédé de localisation et doit le rester. De ce fait, la réalisation d’une imagerie n’est réellement indispensable que s’il y a indication opératoire.
D’une manière générale, la possibilité de lésions multiglandulaires et la nécessité, pour confirmer le diagnostic d’adénome parathyroïdien isolé, de s’assurer du caractère normal des autres glandes, font que l’imagerie préopératoire idéale serait celle qui permettrait de visualiser les quatre glandes, en faisant la distinction entre glandes normales et pathologiques. Aucun procédé d’imagerie n’est actuellement capable de fournir de tels renseignements, alors que la fiabilité de l’exploration (et donc du traitement) chirurgicale est supérieure à 95 %.
L’exploration préopératoire par les procédés actuels d’imagerie est indispensable si on envisage un abord chirurgical latéralisé mini-invasif, et dans ce cas il est préférable d’avoir deux images concordantes de l’adénome. À l’inverse, si le diagnostic de l’HPT1 impose une exploration de toutes les parathyroïdes (par exemple en cas de néoplasie endocrinienne multiple), ou si l’équipe chirurgicale préfère une chirurgie conventionnelle, l’imagerie préopératoire n’apparaît pas indispensable en cas de chirurgie première.
Dans tous les cas, en l’absence de guérison après une première cervicotomie, tous les moyens d’imagerie doivent être mis en œuvre pour tenter de localiser la ou les glandes pathologiques restantes en position normale ou ectopique.
4 . 2 . 1 . 4 - Diagnostic étiologique des HPT
Les examens paracliniques, parfois exhaustifs, orientés en fonction de la clinique et de l’anamnèse ou en fonction des constatations peropératoires et anatomopathologiques doivent permettre de préciser si l’HPT1 est isolée ou si elle n’est qu’une composante de néoplasies endocriniennes multiples (NEM), maladies héréditaires à transmission autosomique dominante.
L’HPT1 isolée représente 98 % des HPT1, qu’il s’agisse d’un adénome unique (96 %), d’adénomes multiples (2 adénomes dans 2 % des cas, exceptionnellement 3 ou 4), ou de rares cancers parathyroïdiens (2 %).
Dans 1 % des cas, les HPT1 font partie d’une NEM1, où l’HPT1 est présente dans plus de 95 % des cas, dont elle est la première manifestation dans environ deux tiers des cas puisque, dans l’histoire naturelle de la maladie, l’HPT1 est la première atteinte détectable biologiquement. Les autres atteintes de la NEM1 sont principalement les tumeurs endocrines pancréatiques et les adénomes hypophysaires, qui doivent alors être systématiquement recherchés. Les NEM1 sont dues à des mutations du gène de la ménine. Dans 1 % des cas, les HPT1 font partie d’une NEM2A, où l’HPT1 est présente dans 25 à 50 % des cas. Les NEM2A sont caractérisées par le développement successif d’un cancer médullaire de la thyroïde (première atteinte dans l’histoire naturelle de la maladie, diagnostiquée par le dosage de la calcitonine), d’une HPT1 avec atteinte multiglandulaire et d’un phéochromocytome bilatéral. Les NEM2A sont dues à des mutations activatrices du proto-oncogène RET. L’HPT1-Jaw syndrome (HPT1 associée à une tumeur osseuse fibreuse de la mandibule) est dû à une mutation du gène HRPT2.
Contrairement aux HPT1 sporadiques (qui surviennent préférentiellement chez les sujets de plus de 60 ans), les HPT1 génétiquement déterminées surviennent dans une population jeune. Toute HPT1 avant l’âge de 40 ans est donc suspecte d’appartenir à une HPT1 familiale génétiquement transmissible.
Les HPT secondaires correspondent à l’adaptation physiologique de la sécrétion parathyroïdienne à une hypocalcémie. Elles sont donc facilement identifiables, en particulier chez les insuffisants rénaux chroniques, chez qui elles sont systématiquement recherchées et prévenues au moyen d’un traitement par métabolites actifs de la vitamine D (alfacalcidol ou calcitriol) et apport calcique. En revanche, l’HPT tertiaire qui résulte de l’autonomisation de l’HPT secondaire par adénome parathyroïdien unique ou multiple peut être la cause d’une hypercalcémie chez l’insuffisant rénal chronique, avant ou après transplantation. Les HPT tertiaires ont la même prise charge thérapeutique que les HPT1 multiglandulaires.