- Pré-requis et Objectifs
-
Cours
-
Contenu
- 1 - Introduction
- 2 - Conduite diagnostique
- 3 - Causes des aménorrhées
- 4 - Conclusion
- Version Enseignants
-
Version PDF

-
Contenu
- Annexes
- Votre Avis
- Ressources Enseignants
3 . 2 - Aménorrhées par anovulation chronique
Les anovulations se caractérisent par l'absence de pic cyclique de LH et de sécrétion de progestérone. La sécrétion d'estradiol peut être absente ou persister : elle est alors acyclique.
La clinique est par conséquent dominée par les anomalies du cycle menstruel. Celles-ci découlent directement de l'absence de transformation cyclique de l'endomètre hyperplasique en endomètre sécrétoire, apte à la nidation. Les troubles des règles sont représentés par une aménorrhée, parfois une oligo-spanioménorrhée ou des ménométrorragies. Ces troubles peuvent alterner chez une même patiente.
3 . 2 . 1 - Anovulations chroniques sans carence estrogénique avec signes d'hyperandrogénie : syndrome des ovaires polykystiques (SOPK) (+++)
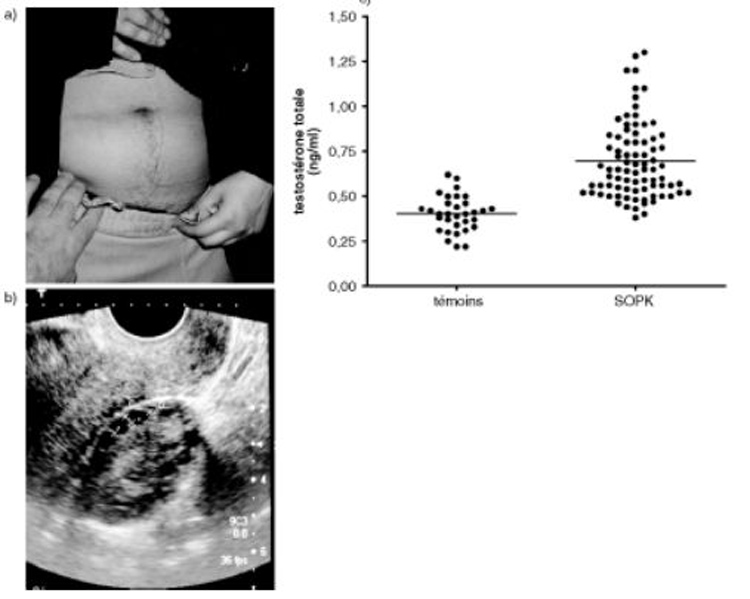
Par sa fréquence, (± 5 % des femmes en âge de procréer) cette maladie constitue une cause majeure d'anovulation (voir aussichapitre 4). Au plan clinique, l'histoire est caractéristique si elle associe, depuis la puberté, des irrégularités menstruelles suivies d'aménorrhée avec acné et hirsutisme (figure 19.6), surpoids dans moins de 50 % des cas et encore plus rarement acanthosis nigricans.
Fig. 19.6. Syndrome des ovaires polykystiques (SOPK)
D’après les critères de Rotterdam, sont en faveur d’un SOPK :
- hyperandrogénie clinique ou biologique ;
- oligo-anovulation ;
- hypertrophie ovarienne ;
- occlusion d’autres causes (cf. texte)
Insistons sur les formes dissociées de SOPK qui sont très fréquentes et peuvent se limiter à une anovulation chronique sans hyperandrogénie clinique ni biologique, avec ou sans élévation excessive de LH. Dans ces cas, le diagnostic, plus difficile, repose surtout sur l'aspect hypertrophié et multikystique des ovaires en échographie (Ovaires > 5,5 cm2 ou 10 mL chacun). En effet, en dehors des SOPK, toute atteinte partielle de l'axe gonadotrope qui laisse persister une sécrétion acyclique d'E2 peut être responsable d'un tableau très voisin : anovulation chronique, sans hyperandrogénie, sans élévation des gonadotrophines après administration de GnRH. Dans ces cas, l’absence d’augmentation de la taille des ovaires à l'échographie oriente le diagnostic vers l'origine gonadotrope de l'anovulation. Le diagnostic peut aussi être aidé, dans ces cas difficiles, par l'administration pulsatile de GnRH : dans le cas des formes dissociées de SOPK, on observe sous pompe à GnRH une augmentation excessive de la taille des ovaires avec un développement multifolliculaire mais sans ovulation ; à l'inverse, en cas d'atteinte hypothalamique, le développement sera monofolliculaire et sera suivi d'une ovulation.
Une autre difficulté diagnostique vient de la fréquence de la macroprolactinémie qui peut faire porter à tort le diagnostic d’hyperprolactinémie chez une patiente en aménorrhée en réalité atteinte d’un SOPK. Dans ces cas, les agents dopaminergiques sont bien entendu inefficaces, ce qui devrait conduire à remettre en cause le diagnostic erroné.
Enfin, insistons encore sur l'absolue nécessité, avant de porter un diagnostic définitif de SOPK, d'avoir éliminé une prise d’anabolisants (critères de Rotterdam, 2003) une sécrétion pathologique de prolactine, ovarienne ou surrénale d'estradiol, d'androgènes ou de cortisol et une hyperplasie congénitale des surrénales par déficit en 21-hydroxylase à révélation tardive (critères de Rotterdam, 2003).
a. Aménorrhées d’origine tumorale ovarienne ou surrénale
Toute hyperandrogénie sévère peut être responsable d'une aménorrhée. Lorsque l'origine est tumorale, il existe en plus de l’hirsutisme des signes de virilisation importants (hypertrophie clitoridienne et des masses musculaires), souvent d'apparition récente. Si la concentration plasmatique de testostérone dépasse 1,5 ng/mL, il faut rechercher une hyperthécose, une tumeur de l'ovaire ou de la surrénale. En l'absence d'imagerie montrant clairement une tumeur virilisante, le diagnostic différentiel entre tumeur ovarienne et hyperthécose nécessite la réalisation d'un cathétérisme simultané des 2 veines ovariennes et d’une veine périphérique pour évaluer le caractère unilatéral ou bilatéral de la sécrétion ovarienne d’androgènes.
Les hyperandrogénies surrénaliennes responsables d’aménorrhée, souvent associées à un hypercortisolisme, peuvent être consécutives à une sécrétion directe de testostérone par la tumeur ou au métabolisme périphérique de ses précurseurs, 4-androstènedione, DHEA ou DHEAS, sécrétés en excès. Une fois évoqué, le diagnostic sera facilement confirmé par un scanner des surrénales.
Finalement, un déficit enzymatique surrénal, surtout en 21-hydroxylase, beaucoup plus rarement en 11-hydroxylase ou en 3b – hydroxystéroïde déshydrogénase, doit être éliminé. Dans les formes classiques de déficit en 21-hydroxylase, l’aménorrhée peut être secondaire à une atrophie endométriale voire un déficit gonadotrope induits par la sécrétion surrénale permanente de progestérone. Les formes à révélation tardive n'intéressent en pratique que les déficits en 21-hydroxylase. Ce diagnostic sera envisagé surtout si le taux basal, prélevé le matin, de 17-hydroxyprogestérone est supérieur à 2 ng/ml(cf. note : *). Il sera souvent nécessaire de l’étayer par une stimulation par l'ACTH (test au Synacthène® ordinaire), qui montrera une élévation supérieure à 10 ng/mL, et il sera confirmé par le séquençage du gène codant pour la 21-hydroxylase.
3 . 3 - Insuffisances ovariennes primitives
Elles regroupent différentes affections ovariennes ayant comme dénominateur commun une atteinte de la folliculogenèse. La signature biologique constante en est l'élévation de FSH (figure 19.7). Si l'épuisement du capital folliculaire se complète avant l’âge de la puberté, la présentation clinique sera celle d'une absence complète de développement mammaire avec une aménorrhée primaire. Lorsque la disparition des follicules ovariens a lieu pendant ou après la puberté, on observera un développement variable des seins avec une aménorrhée primaire ou secondaire, avec ou sans bouffées de chaleur, dyspareunie, et le test aux progestatifs sera positif ou négatif en fonction de la sécrétion résiduelle d’estradiol. Les dosages hormonaux mettent en évidence une élévation des concentrations des gonadotrophines, surtout de FSH (figure 19.7), avec des taux plasmatiques d'estradiol souvent bas mais pouvant fluctuer voire s’élever avant l’épuisement complet du capital folliculaire.
Devant toute insuffisance ovarienne primitive ne pouvant être expliquée par une atteinte chirurgicale, une chimiothérapie ou une radiothérapie, il est nécessaire de rechercher en premier lieu une anomalie du caryotype, une anomalie du gène FMR1 (Fragile X Mental Retardation), responsable du syndrome de l’X fragile et une atteinte auto-immune.
Fig. 19.7. Concentrations sériques de FSH chez des femmes ayant consulté pour aménorrhée, comparativement à celles de femmes normales cyclées, évaluées entre le 3eet le 6ejour du cycle (témoins)
3 . 4 - Aménorrhées par anomalie utérine
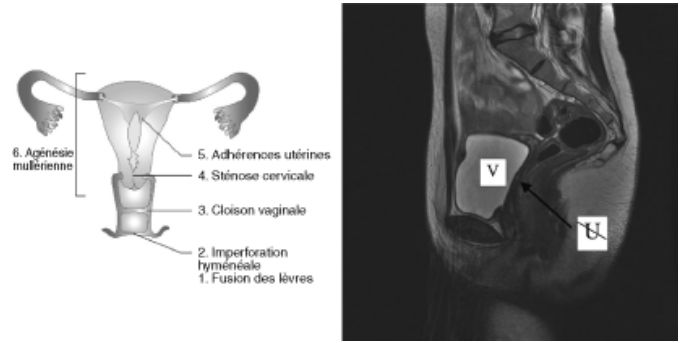
Les anomalies congénitales du tractus génital pouvant être responsables d'une aménorrhée primaire ne sont pas exceptionnelles. Les signes d'accompagnement seront fonction du siège et du degré de la malformation (figure 19.8). Une imperforation hyménéale ou une malformation vaginale seront suspectées chez une jeune fille ayant un développement pubertaire normal et des douleurs pelviennes cycliques. Elles seront confirmées par l'examen gynécologique complété par l’imagerie voire une endoscopie des organes génitaux. Une agénésie de l’utérus (figure 19.8) sera évoquée devant un tableau similaire sans douleurs.
Fig. 19.8. Aménorrhées par anomalie utérine
Le principal problème diagnostique en l'absence d'ambiguïté sexuelle est de faire la différence entre une agénésie mullérienne isolée et des anomalies sévères de la biosynthèse ou de la réceptivité aux androgènes. On pourra trancher grâce à la mesure de la testostérone plasmatique (concentrations masculines adultes en cas d’insensibilité aux androgènes) et de ses précurseurs (par exemple, androstènedione en cas de déficit en 17b – hydroxystéroïde déshydrogénase) qui, anormaux, feront pratiquer un caryotype et déclencher les analyses moléculaires adaptées.
Les aménorrhées secondaires d'origine utérine sont la conséquence de synéchies utérines secondaires à des gestes traumatiques sur l'utérus (curetages répétés, IVG, chirurgie pour myomes ou césarienne). Plus rarement en France, il peut s'agir d'une tuberculose utérine.
Notes
- * : Mais un taux de 170 M < 3 mg ne l’exclut pas formellement.
5/6