- Pré-requis et Objectifs
-
Cours
-
Contenu
- 1 - Introduction
- 2 - Conduite diagnostique
- 3 - Causes des aménorrhées
- 4 - Conclusion
- Version Enseignants
-
Version PDF

-
Contenu
- Annexes
- Votre Avis
- Ressources Enseignants
3 . 1 . 2 - Hyperprolactinémies
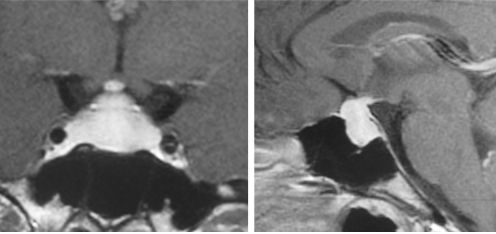
Cette cause est également traitée dans le chapitre consacré aux adénomes hypophysaires (cf. chapitre 12). Au plan diagnostique, il faut simplement insister sur le fait qu’elles sont responsables de 20 % des anovulations, donc une cause majeure d’aménorrhée avec galactorrhée ou non. Elles résultent le plus souvent, en l’absence de prise de médicaments hyperprolactinémiants, de l’existence de tumeurs de la région hypothalamo-hypophysaire, adénomes à prolactine (figure 19.4) ou non. Au plan symptomatique, l’hyperprolactinémie peut débuter par des irrégularités menstruelles puis se compléter par une aménorrhée qui traduit alors simplement une atteinte gonadotrope plus profonde. Bien que les causes d'hyperprolactinémies se situent fréquemment à l'étage hypophysaire, l'effet antigonadotrope de la prolactine s'exerce de façon prédominante, sinon exclusive, au niveau hypothalamique. Il a été clairement démontré que l'hyperprolactinémie diminue la fréquence des pulses de LH par atteinte hypothalamique. La preuve en est apportée par l'administration pulsatile de GnRH exogène capable de rétablir une pulsatilité de LH et une fonction ovarienne normales alors même que l'hyperprolactinémie persiste.
Fig. 19.4. Micro et macroadénome à prolactine révélés par une aménorrhée secondaire
Pour conclure sur cette cause majeure d’aménorrhée, il faut rappeler que l’établissement du diagnostic positif d’hyperprolactinémie suppose de mesurer la prolactine avec un dosage de bonne qualité reconnaissant le moins possible les macroaggrégats de cette hormone qui sont une source très fréquente de fausses hyperprolactinémies et donc d’erreurs diagnostiques. Enfin, il faut se souvenir qu’hyperprolactinémie n’est pas synonyme d’adénome à prolactine. Tout traitement sans imagerie hypophysaire préalable doit être considéré comme une faute médicale.
3 . 1 . 3 - Aménorrhées liées à d'autres endocrinopathies
L'hypercortisolisme, indépendamment de son étiologie, est une cause importante d'aménorrhée. Celle-ci résulte essentiellement du déficit gonadotrope induit par les glucocorticoïdes. Dans les corticothérapies au long cours, l'atteinte osseuse liée à l'excès de glucocorticoïdes est aggravée par la carence estrogénique. En l'absence de contre-indication liée à la maladie causale, un traitement substitutif estroprogestatif doit donc être instauré.
Les troubles des règles sont plus rares au cours des dysthyroïdies. En l'absence d'une atteinte gonadotrope ou ovarienne associée (par exemple, d’origine auto-immune), ils régressent avec le traitement de la dysthyroïdie.
Les déficits en 21-hydroxylase sont une cause classique d’aménorrhée. Dans les formes classiques, le diagnostique étiologique, déjà porté à la naissance ou pendant l’enfance, ne pose pas de problème. L’aménorrhée est ici liée au déficit gonadotrope et à l’atrophie endométriale induits par les progestatifs sécrétés en excès par la surrénale pathologique.
3 . 1 . 4 - Déficits gonadotropes d'origine hypophysaire
Ils sont beaucoup plus rares que les atteintes hypothalamiques. Au plan étiologique, l’exceptionnel syndrome de Sheehan résulte classiquement d'une nécrose hypophysaire du post-partum à la suite d'un accouchement hémorragique avec collapsus vasculaire. Le tableau clinique, bien connu, associe une aménorrhée du post-partum et une absence de montée laiteuse. Les déficits gonadotrope et lactotrope en sont la cause chez ces malades qui présentent, en réalité, une insuffisance antéhypophysaire globale. En fait, une grande majorité des aménorrhées par déficit gonadotrope du post-partum est due à une atteinte auto-immune de l'hypophyse. Ces hypophysites lymphocytaires (++) peuvent, comme la nécrose hypophysaire, se révéler par une absence de montée laiteuse et une aménorrhée du post-partum, mais il manque la notion étiologique d'accouchement hémorragique. L'IRM hypophysaire permet de suspecter le diagnostic en montrant une grosse hypophyse en hypersignal spontané, parfois d'allure pseudotumorale (figure 19.5), ou inversement une selle turcique vide. De même, l'existence d'une insuffisance antéhypophysaire dissociée est en faveur de ce diagnostic. La recherche d'anticorps antihypophyse est de technique peu fiable et peu sensible. Le seul examen permettant d'affirmer le diagnostic d'hypophysite serait l'étude anatomopathologique par biopsie, trop agressif pour être réalisé en pratique.
Une cause maintenant classique bien que rare d’aménorrhée par déficit gonadotrope d’origine hypophysaire est constituée par les mutations du récepteurs de la GnRH. Chez ces femmes, l’aménorrhée primaire ou primo-secondaire s’accompagne souvent d’un certain développement pubertaire qui, parfois, peut être quasi complet et s’accompagner même d’une oligo-spanioménorrhée. Au plan hormonal, en fonction de l’atteinte gonadotrope, l’estradiol et les gonadotrophines peuvent être effondrés ou atteindre des valeurs proches de celles d’une phase folliculaire.
Plus exceptionnels sont les déficits gonadotropes par atteinte génétique des gonadotrophines. En 1993, un cas d'aménorrhée primaire lié à un déficit en FSH mais avec sécrétion exagérée de LH a été rapporté. Des ovulations chez cette patiente ont été induites par l'utilisation de FSH exogène, ce qui a permis d'obtenir une grossesse. Le séquençage du gène de la sous-unité bde FSH a mis en évidence une délétion de deux nucléotides induisant un déplacement du cadre de lecture, l’apparition d’un codon stop et d’une protéine tronquée incapable de se lier à la sous-unité a. D’autres cas d'aménorrhée primaire par mutation du gène de la sous-unité bde FSH ont depuis été décrits chez des patientes avec aménorrhée primaire associées à une FSH indétectable et une LH élevée.
Des mutations de LH ont aussi été observées. Elles réalisent parfois un tableau de LH « invisible » en IRMA mais détectable en RIA. Dans ce cas, les LH mutées sont biologiquement actives et dépourvues de conséquence pathologique. Il s'agit donc d'un simple polymorphisme. Plus récemment a été observée une forme familiale de déficit isolé en LH chez une femme présentant une aménorrhée primaire.
Dans les déficits gonadotropes d'origine hypophysaire, l'administration pulsatile de GnRH exogène sera peu ou pas efficace. S'il y a désir de grossesse, une ovulation sera plus facilement obtenue après administration de gonadotrophines.
4/6