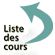3
-
Ischémie, infarctus, infarcissement hémorragique
3
.
1
-
Ischémie
3
.
1
.
1
-
Définition
L’ischémie est une diminution (ischémie relative), ou abolition (ischémie complète) de l’apport sanguin artériel dans un territoire limité de l’organisme.
Elle provoque une hypoxie (diminution relative de l’oxygène délivré au tissu par rapport à ses besoins) ou, selon son degré de sévérité, une anoxie (suppression de l’apport d’oxygène au tissu).
3
.
1
.
2
-
Causes des ischémies
Ce sont toutes les causes d’oblitération partielle ou totale d’une lumière artérielle, parfois intriquées : athérosclérose, artérite (maladie inflammatoire primitive de la paroi artérielle), thrombose, embolie, compression extrinsèque, spasme artériel prolongé, dissection artérielle.
Les conséquences d’une oblitération partielle d’une lumière artérielle peuvent être aggravées par des conditions générales : chute du débit cardiaque ou anémie profonde, par exemple.
3
.
1
.
3
-
Facteurs influençant le retentissement de l’ischémie
-
L’intensité et la durée de l’ischémie.
-
La sensibilité du tissu et du type cellulaire à l’anoxie : les neurones sont très sensibles à l’ischémie (lésions irréversibles après 3 à 5 min d’anoxie), de même que le myocarde (20–30 min) et les cellules épithéliales.
-
La possibilité d’une circulation de suppléance : les organes naturellement riches en anastomoses (estomac, intestin), ou pourvus d’une double circulation (poumons, foie) seront plus résistants.
-
La rapidité d’installation : une ischémie brutale ne laisse pas le temps à une circulation de suppléance de se développer. Si elle se prolonge, elle entraîne des lésions cellulaires irréversibles : nécrose tissulaire. Une ischémie partielle, chronique, permet l’installation progressive d’une circulation de suppléance et est responsable de lésions d’atrophie et de fibrose progressives.
3
.
1
.
4
-
Conséquences de l’ischémie
Elles dépendent des facteurs qui viennent d’être cités. Schématiquement :
-
une ischémie complète et étendue sera responsable d’une nécrose complète du territoire d’ischémie : infarctus, ramollissement, gangrène ;
-
une ischémie incomplète et transitoire s’accompagnera de douleurs intenses mais transitoires survenant lors de la phase ischémique, et auxquelles correspondent divers termes de séméiologie : claudication intermittente d’un membre inférieur/angor d’effort/angor intestinal ;
-
une ischémie incomplète et chronique entraînera l’apparition d’une atrophie (avec apoptose des cellules les plus fonctionnelles) avec remplacement progressif du tissu par de la fibrose (ex : sténose de l’artère rénale responsable d’une atrophie et d’une fibrose du rein).
3
.
2
-
Infarctus
3
.
2
.
1
-
Définition
L’infarctus est un foyer circonscrit de nécrose ischémique dans un viscère, consécutif à une obstruction artérielle complète et brutale.
Historiquement, ce terme a été choisi par Laennec pour décrire la lésion dans le poumon (du latin infarcere – « remplir de sang »). En fait, beaucoup d’infarctus ne sont pas associés à une inondation hémorragique du territoire nécrosé. Il existe ainsi deux variétés d’infarctus.
3
.
2
.
2
-
Variétés morphologiques d’infarctus
3
.
2
.
2
.
1
-
Infarctus blanc
L’infarctus blanc est un territoire de nécrose ischémique exsangue, dans un organe plein, par obstruction d’une artère terminale. Le territoire atteint subit une nécrose de coagulation.
Ce type d’infarctus peut toucher : le cœur, les reins, la rate, le cerveau, etc.
3
.
2
.
2
.
1
.
1
-
Aspects macroscopiques
Aspects macroscopiques
On peut distinguer plusieurs phases :
-
de 6 (et surtout de 24) à 48 heures, la lésion devient progressivement visible. Elle correspond à un territoire de distribution artérielle (forme pyramidale à base périphérique), plus pâle et plus mou que le reste de l’organe, devenant progressivement plus nettement blanc ou jaunâtre et entouré d’un liseré congestif rouge ;
-
au cours des 1re et 2e semaines : les limites de l’infarctus sont de plus en plus nettes, sa surface est déprimée par rapport au tissu sain. Il est entouré d’un tissu mou et rouge (tissu de granulation inflammatoire, puis bourgeon charnu) (figure 4.12) ;
-
à partir de la 3e semaine, se constitue progressivement une cicatrice blanchâtre, fibreuse, avec amincissement et rétraction de la zone lésée (figure 4.13).
3
.
2
.
2
.
1
.
2
-
Aspects microscopiques
Aspects microscopiques
-
Avant 6 heures (stade précoce), il n’y a pratiquement pas d’anomalie microscopique visible avec les techniques de microscopie optique conventionnelle : les lésions microscopiques sont peu marquées, sans spécificité (des lésions seraient visibles plus précocement en microscopie électronique).
-
De 6 à 48 heures, on observe une nécrose de coagulation, conservant les contours cellulaires, progressivement entourée et pénétrée par une réaction inflammatoire aiguë, riche en polynucléaires.
-
Pendant le reste de la 1re semaine, le territoire nécrosé subit une détersion progressive, centripète, par des macrophages, avec remplacement du tissu nécrosé par un bourgeon charnu.
-
Après 1 à 2 semaines, débute la cicatrisation : organisation conjonctive, fibrose.
3
.
2
.
2
.
1
.
3
-
Exemple : le cœur
Exemple : le cœur
L’infarctus du myocarde présente une importance particulière du fait de sa grande fréquence et de sa gravité. Sa cause principale est l’athérosclérose coronaire. La topographie de l’infarctus sera déterminée par le siège de l’obstruction. L’étendue peut être variable selon le calibre de la coronaire atteinte. La distribution de l’infarctus dans l’épaisseur de la paroi est aussi variable : infarctus transmural (occupant toute l’épaisseur de la paroi) ou sous-endocardique (limité aux couches les plus internes). En dehors des troubles de la fonction ventriculaire (insuffisance cardiaque, troubles du rythme), les complications locales principales en sont : la thrombose murale intracavitaire, la rupture de pilier avec insuffisance valvulaire aiguë, la rupture pariétale avec hémopéricarde, la péricardite, l’anévrisme ventriculaire.
3
.
2
.
2
.
1
.
4
-
Formes topographiques et évolutives
Formes topographiques et évolutives
-
Ramollissement : désigne un infarctus blanc cérébral (qui prend très rapidement une consistance très molle).
-
Gangrène « sèche » : infarctus localisé d’une extrémité (orteil, membre, nez, oreille) consécutif à l’oblitération d’une artère terminale.
-
Suppuration : par surinfection ou lors d’un infarctus après migration d’embole septique.
3
.
2
.
2
.
2
-
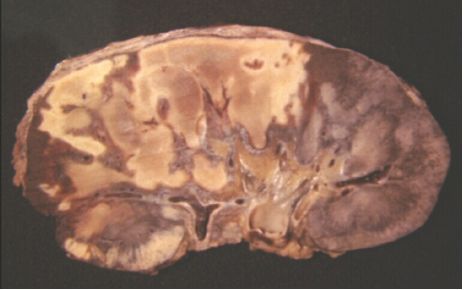
Infarctus rouge
L’infarctus rouge est un territoire de nécrose ischémique par obstruction d’une artère terminale dans lequel apparaît secondairement une inondation hémorragique en rapport avec une double circulation ou avec une abondante circulation collatérale.
Ce type d’infarctus touche notamment :
- les poumons, qui disposent d’une double vascularisation artérielle (pulmonaire et bronchique) ;
- l’intestin grêle, irrigué par une importante circulation collatérale. La physiopathologie de l’infarctus rouge est moins évidente que celle de l’infarctus blanc.
On suppose que l’apport sanguin provenant de la circulation collatérale ou complémentaire est insuffisant pour éviter la nécrose ischémique. D’autres phénomènes pourraient mettre en jeu l’ouverture retardée de shunts entre les deux voies d’irrigation artérielle, avec à-coup tensionnel et érythrodiapédèse massive. D’autres explications ont été proposées : reflux de sang veineux par exemple. La constitution de l’infarctus rouge serait aussi favorisée par une structure lâche de l’organe (poumon).
3
.
2
.
2
.
2
.
1
-
Aspects macroscopiques et microscopiques
Aspects macroscopiques et microscopiques
Dans le poumon : la cause essentielle est l’embolie pulmonaire (dans une artère pulmonaire périphérique). Le territoire d’infarctus est initialement rouge sombre, mal limité, plus ferme que le tissu adjacent. Comme pour tout infarctus situé dans un organe plein, il est typiquement de forme pyramidale, à base périphérique (versant pleural) (figure 4.14). Histologiquement, on observe une nécrose de coagulation laissant persister l’architecture alvéolaire pré-existante, mais avec infiltration hémorragique massive du tissu. L’évolution est semblable à celle d’un infarctus blanc, mais la cicatrice restera pigmentée, englobant des histiocytes chargés de pigment hémosidérinique.
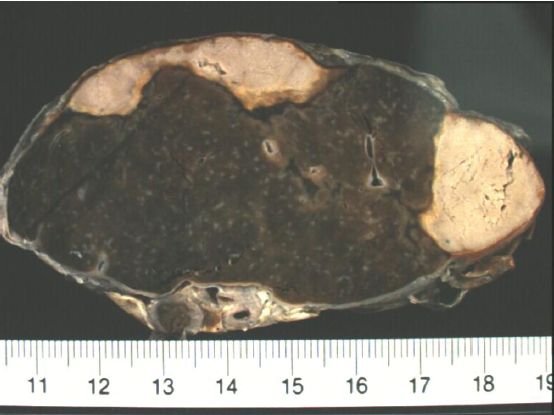
Dans l’intestin grêle : l’obstruction touche le plus souvent une branche de l’artère mésentérique supérieure (thrombose sur plaque athéroscléreuse pré-existante ou embolie) entraînant une nécrose ischémique des anses intestinales situées dans le territoire correspondant, secondairement inondée de sang provenant de la circulation collatérale. Ce segment intestinal est noirâtre ou violacé, induré, à paroi épaisse mais fragile. L’infiltration hémorragique s’étend souvent dans le mésentère (figure 4.15).
3
.
2
.
2
.
2
.
2
-
Évolution
Evolution
- Au niveau pulmonaire, risque de surinfection.
- Au niveau intestinal, risque majeur de péritonite par perforation (urgence chirurgicale).
3
.
3
-
Infarcissement hémorragique
L’infarcissement hémorragique est une nécrose viscérale hémorragique par obstruction d’une veine de drainage.
C’est le degré maximum de l’anoxie due à une stase veineuse. Il n’y a pas d’obstruction artérielle. Il est causé par une thrombose veineuse (intestin : thrombose de la veine mésentérique), ou une compression veineuse (ex : torsion d’un pédicule vasculaire au cours d’un volvulus). Il siège notamment au niveau de l’intestin grêle et du mésentère, du poumon, du cerveau, du testicule.
Les caractéristiques macroscopiques et microscopiques sont souvent impossibles à distinguer de celles d’un infarctus rouge. L’évolution est identique.
4/7