4.
2.
2 - Ventilation
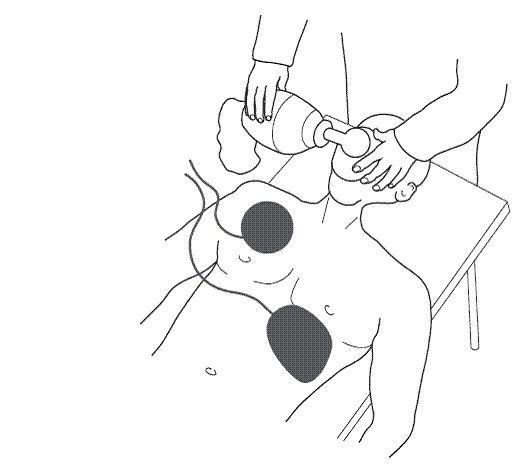
La ventilation, et donc l’oxygénation du patient sont améliorées par l’intubation trachéale et l’administration d’oxygène à FiO2 = 1. L’intubation protège les voies aériennes sous-glottiques des régurgitations d’origine digestive (ce qui n’est pas nécessairement le cas lors de l’utilisation d’un masque laryngé). La ventilation manuelle par un insufflateur autogonflable (Ambu) en utilisant des volumes courants de 500 à 800 mL (VT de 10 mL/kg environ en air, et de 7 mL/kg en O2 pur) est généralement recommandée car la plus efficace. Quand le patient est intubé, il est moins indispensable de synchroniser systématiquement massages et ventilation. L’adjonction d’une pression positive téléexpiratoire peut s’avérer nécessaire en cas d’œdème pulmonaire. La ventilation par respirateur mécanique volumétrique est déconseillée tant que le MCE est nécessaire.
Récemment, un nouveau mode de ventilation a été proposé : l’insufflation continue d’oxygène intratrachéal (ICO). Il fait appel à une sonde d’intubation modifiée (Boussignac) dont la paroi renferme huit microcanalicules connectés à une source d’O2 délivrant 15 L/min d’O2 : cette insufflation génère une pression endotrachéale continue d’environ 10 cmH2O. Pendant la RCP, la ventilation est entretenue par les mouvements thoraciques générés par le MCE et l’ICO (sans nécessité d’insufflation intermittente). Cette technique en cours de validation a l’avantage de ne mobiliser qu’un seul sauveteur.
4.
2.
3 - Pose d’un abord veineux
Un abord veineux central jugulaire interne ou sous-clavier doit être envisagé dès que les conditions de sa mise en place sont réunies. Sa supériorité en efficacité sur la voie d’abord périphérique est démontrée au cours de l’AC. En effet, si la mise en place d’un cathéter périphérique court est possible sans interruption du MCE, elle retarde néanmoins la distribution des médicaments au niveau central et ne permet pas l’administration de solutés hypertoniques et/ou très alcalins. L’administration intracardiaque de médicaments injectables est dorénavant abandonnée. Dès que le malade est intubé, l’administration endotrachéale d’adrénaline peut être effectuée en l’absence de disponibilité de voie veineuse.
4.
2.
4 - Arsenal pharmacologique
Lorsque la RCPE ou les premiers CEE n’ont pas rapidement permis de recouvrer un état hémodynamique stable, les chances de survie sans séquelles notables s’amenuisent. Il est alors nécessaire d’avoir recours à des substances médicamenteuses.
a. Médicaments vasoactifs
L’ adrénaline reste le médicament de choix en première intention lorsque le cœur n’est pas en FV ou quand une première salve de CEE réalisée dans des conditions satisfaisantes ne conduit pas au retour d’un état hémodynamique efficace (Figure 2). Son intérêt est double : l’adrénaline est un inotrope positif et un vasopresseur. Elle augmente donc le retour veineux et la pression aortique télédiastolique au cours du MCE, favorisant par-là certains débits régionaux (en particulier cérébral et coronaire). La posologie préconisée est de 1 mg par voie intraveineuse en bolus répétés toutes les 3 min. En cas d’asystolie persistante, une posologie de 5 mg peut être utilisée. Certains schémas dont la supériorité n’est pas démontrée proposent d’injecter d’abord 1 mg, puis 3 min plus tard 3 mg, puis 3 min plus tard 5 mg. L’adrénaline peut aussi être administrée par voie intratrachéale (à posologies 3 fois plus élevées qu’en intraveineux, diluées dans 10 mL de sérum physiologique). Même en cas d’asystolie ou de dissociation électromécanique, l’adrénaline peut générer per se une FV.
Aucun sympathomimétique catécholaminergique de synthèse n’a plus aujourd’hui sa place dans le traitement initial de l’arrêt cardiaque (isoprénaline, dobutamine, dopexamine) ; en revanche, des alternatives comme la noradrénaline, catécholamine naturelle, ou la phényléphrine, sympathomimétique non catécholaminergique, ont été utilisées avec succès chez l’homme sans toutefois s’avérer supérieures à l’adrénaline.
D’autres substances vasoactives de nature hormonale se sont avérées capables de restaurer une efficacité circulatoire malgré l’hypoxie et l’acidose dans certaines conditions expérimentales. Il s’agit de l’arginine-vasopressine (40 U, en dose unique) et de l’angiotensine II : en pratique quotidienne, leur place restera à définir quand elles seront commercialisées.
b. Alcalinisants
En pratique, l’administration systématique d’alcalinisants n’est plus recommandée sauf en cas d’acidoses et/ou d’hyperkaliémies documentées préexistantes à l’AC, d’intoxications par cardiotropes dromotropes négatifs (antiarythmiques, antidépresseurs tricycliques, buflomédil, etc.) ou d’arrêts prolongés (> 10 min).
Les seuls alcalinisants encore disponibles sur le marché sont les bicarbonates de sodium. De faibles posologies sont préconisées, comme 1 mmol de base/kg (soit 1 mL de bicarbonate à 84 ‰/kg) par voie intraveineuse sur un cathéter central. Cette posologie peut être répétée à demi-dose sous couvert d’une analyse de l’équilibre acido-basique toutes les 10 à 15 minutes tant que l’AC se poursuit : l’objectif est de faire passer le pH intravasculaire au-dessus de 7,25 pour permettre une action optimale de l’adrénaline sur ses récepteurs vasculaires (sans provoquer d’hypercapnie secondaire).
c. Antiarythmiques
En cas de FV persistante, après correction des désordres hydroélectrolytiques et reperfusion coronaire le cas échéant, la lidocaïne en bolus (1 mg/kg) suivie d’une perfusion continue (1 à 3 mg/min) a été proposée pour prévenir la récidive des extrasystoles ventriculaires. Récemment, a été souligné l’intérêt de l’amiodarone (300 à 600 mg/j par voie intraveineuse lente) dans le traitement de ces troubles du rythme.
L’intérêt du sulfate d’atropine a été rapporté, en association avec l’adrénaline, pour lever un éventuel blocage vagal, en particulier en cas de troubles du rythme lents résurgents de façon itérative après cardioversion d’une FV. La place du sulfate de magnésium (1 à 2 g en intraveineux suivis d’une perfusion continue pour maintenir une magnésiémie < 3 mmol/L) est établie de longue date dans le traitement de certains troubles du rythme. Dans l’AC, il n’est recommandé que si l’on fait face à certaines variétés de torsades de pointe et s’il y a une notion de traitements diurétiques au long cours sans compensation potassique et magnésique.
d. Remplissage vasculaire
Un bon fonctionnement hémodynamique requiert un remplissage vasculaire adéquat. Chaque fois qu’une hypovolémie est suspectée, une expansion volémique par soluté physiologique salé ou par macromolécules est nécessaire. Des études bien conduites ont montré que les solutés glucosés sont à éviter, parce que toute hyperglycémie est préjudiciable à l’ischémie cérébrale postanoxique. Le choix du volume de remplissage doit tenir compte du risque de majoration de l’œdème cérébral contemporain des phénomènes de reperfusion après AC. En l’état actuel des connaissances, la sagesse veut que la correction volémique et l’hydratation se fassent sur le mode de l’économie, si nécessaire sous surveillance hémodynamique invasive.
e. Protection cérébrale
Elle est depuis longtemps l’un des principaux enjeux de la période succédant à un AC. De nombreuses tentatives ont été entreprises pour découvrir un traitement qui fasse la preuve de son efficacité à prévenir voire guérir les lésions cérébrales postanoxiques. En l’état actuel des connaissances, aucune drogue ne peut être définitivement conseillée. Il faut en revanche insister sur l’impérative nécessité de ne pas majorer les lésions existantes par des interventions thérapeutiques responsables d’une hypoxie supplémentaire, d’une hypoperfusion cérébrale ou de convulsions. Il est ainsi impératif de maintenir une ventilation alvéolaire normale (PaO2 proche de 100 mmHg, PaCO2 proche de 32 mmHg), un pH proche de 7,40, un équilibre glycémique et hydroélectrolytique.
f. Conclusion
Savoir reconnaître et traiter un AC est une urgence que doit maîtriser tout médecin. De la précocité du diagnostic et donc du déclenchement de la chaîne de survie dépend le pronostic vital et fonctionnel du malade. Bien qu’en progrès, ce pronostic reste dramatique à cause de la prévalence de la maladie coronarienne et d’un défaut évident d’éducation de la population : moins de 10 % des malades ayant présenté un AC préhospitalier sortiront sans séquelles de l’hôpital. La diffusion de la technique de défibrillation semi-automatique est censée améliorer ce pronostic. Enfin, tout malade ayant présenté un AC, même bref ou réversible sans séquelles apparentes, doit être hospitalisé en réanimation pour bilan exhaustif et surveillance clinique spécialisée.
7/7