2 - Polymérisation
Deux mécanismes entièrement différents sont utilisés pour la synthèse de polymères lors de la polymérisation.
Le premier type de réaction est appelé polymérisation par étape où la croissance des macromolécules est le résultat de réactions chimiques classiques entre les groupements fonctionnels réactifs des monomères.
Une réaction de polycondensation avec libération d’un sous-produit de la réaction, (souvent de l’eau…) est une réaction de polymérisation par étape.
Le deuxième type de réaction est appelé polymérisation en chaîne et résulte de la formation d’un centre actif A* qui fixe de façon successive de nombreuses molécules de monomère :
A* + M à AM* puis AM* + nM à AM*n+1
Le polymère obtenu présente un degré de polymérisation n+1.
Une réaction de polyaddition sans libération de sous produit est une réaction de polymérisation en chaîne. Dans ce cas, le mécanisme implique généralement l’ouverture d’une double liaison (C=C, par exemple) ou l’ouverture d’un cycle.
2 . 1 - Représentation schématique de la polymérisation
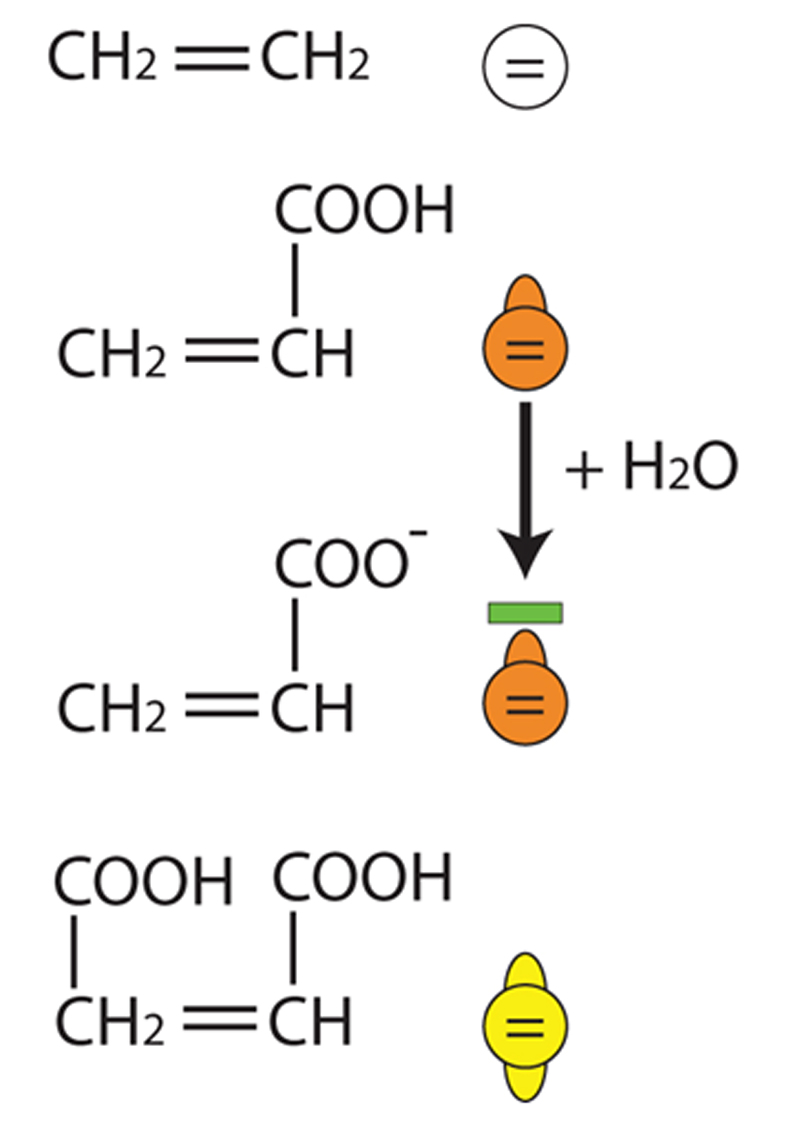
La chimie macromoléculaire peut se représenter de façon stylisée et schématique sous la forme d’un jeu de construction en deux ou trois dimensions où les macromolécules en présence sont représentées sous la forme de billes reliées les unes aux autres.
Chacune des billes peut être liée à deux ou quatre autres, suivant sa constitution. Celles-ci possèdent des propriétés physico-chimiques intrinsèques pouvant également être schématisées. La bille peut être simple ou plus complexe en fonction de ses propriétés propres. Des groupements chimiques fonctionnels peuvent être représentés par de petits bras attachés sur la bille monomère et leur fonction spécifique peut être, elle aussi, représentée.
Par exemple, un groupement fonctionnel acide sera représenté par un bras portant un signe négatif (-) à son extrémité.
La liaison covalente fonctionnelle du monomère est elle aussi schématisée dans la bille du monomère. Sur la figure 1 où est représenté l’acide acrylique, la bille représente le squelette carboné, le bras représente le groupement fonctionnel acide carboxylique (-COOH) capable d’être ionisé en présence d’eau. La double liaison réactive est représentée par le symbole = dans la bille.
D’autres monomères plus complexes peuvent être représentés de la même façon.
La chimie macromoléculaire des polymères en odontologie cosmétique fait appel à la polymérisation en chaîne et plus particulièrement à la polymérisation radicalaire où la croissance du polymère a lieu par addition des molécules de monomère en fin de chaîne.
2 . 2 - Polymérisation radicalaire
Un amorceur de la réaction chimique peut être excité par la chaleur ou par la lumière. En odontologie, la photopolymérisation est fréquemment utilisée pour les matériaux composites dont la matrice est un polymère.
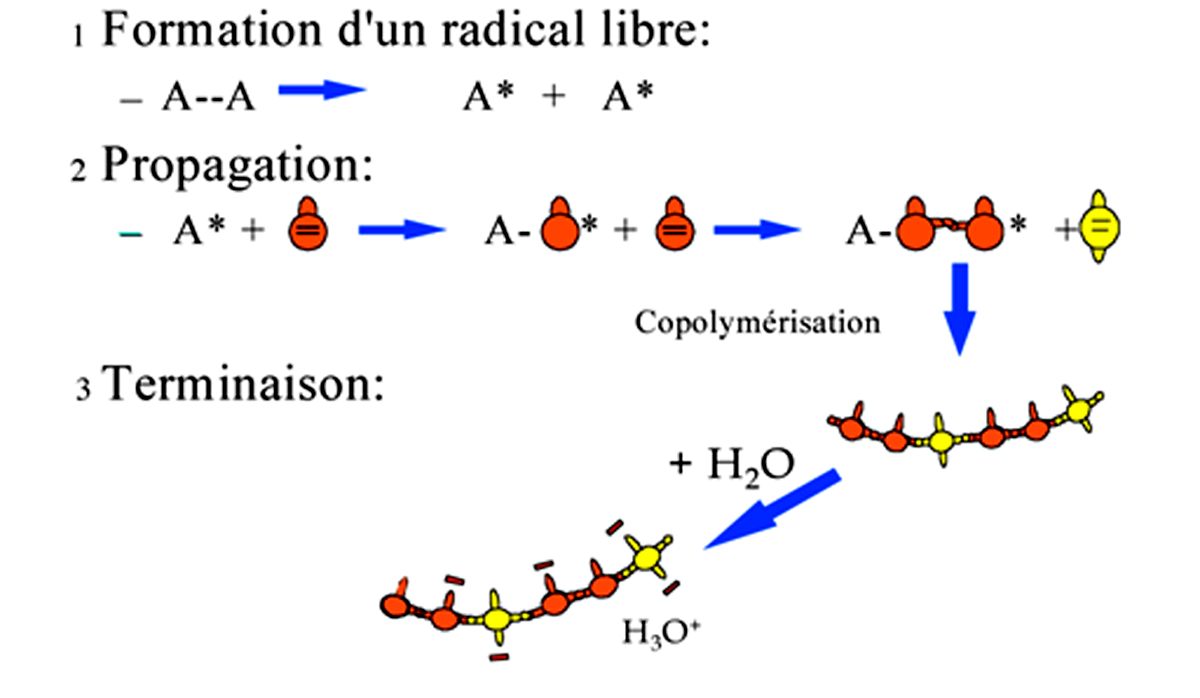
Un photo-amorceur excité se transforme en un radical libre très instable qui va interagir avec la monomère le plus proche. Celui-ci est une molécule porteuse d’une double liaison réactive. Le radical libre va capter un électron d’un des doublets électroniques de la double liaison pour former une liaison covalente entre l’amorceur et le monomère. Cette réaction a consommé un électron du radical libre et un électron de la double liaison du monomère. L’autre électron de cette double liaison va chercher très rapidement lui aussi à se lier et va ouvrir la double liaison d’un autre monomère…
La molécule formée de l’amorceur et du monomère devient un radical libre qui va réagir avec un autre monomère proche, porteur d’une double liaison. C’est la propagation de la réaction de polymérisation radicalaire.
Cette propagation se fait très rapidement dans le milieu réactionnel jusqu’à la terminaison pour aboutir à la formation de macromolécules d’un haut poids moléculaire.La polymérisation radicalaire d’un copolymère d’acide acrylique et méthacrylique est représentée sur la figure 2.
Chaque monomère excité se lie, grâce à l’ouverture de sa double liaison, à un monomère adjacent qui peut être de l’acide acrylique ou de l’acide méthacrylique, aboutissant à la formation d’un copolymère.