3
-
Phase générale du cancer : la métastase
3
.
1
-
Définitions
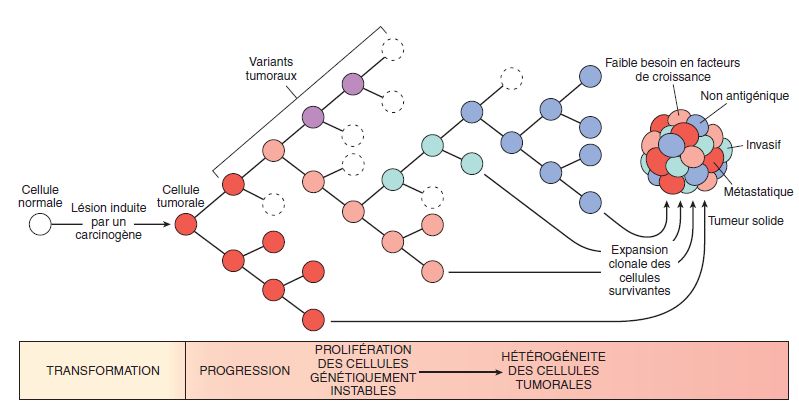
La progression tumorale dépend du pouvoir prolifératif et du pouvoir métastasiant.
Après une phase locale, les métastases (du grec métastasis : déplacement) font toute la gravité de la maladie cancéreuse.
Les métastases sont des foyers cancéreux secondaires, développés à distance de la tumeur primitive, et dont la croissance est autonome, indépendante de celle de la tumeur primitive.
Le moment d’apparition des métastases dans l’histoire naturelle d’un cancer est variable :
- elles peuvent être révélatrices d’une tumeur primitive jusque-là asymptomatique et donc méconnue (ex : métastase cérébrale symptomatique d’un mélanome cutané non diagnostiqué) ;
- elles peuvent être contemporaines de la tumeur primitive et sont découvertes, soit lors du bilan d’extension, soit parce qu’elles entraînent des symptômes cliniques ;
- elles peuvent survenir au cours de l’évolution d’un cancer traité parfois très tardivement alors que la tumeur primitive est éradiquée par la thérapeutique (plus de 10 ans parfois, notamment pour certains cancers du rein ou du sein).
Elles vont souvent de pair avec la résistance au traitement.
Une très faible proportion des cellules tumorales circulantes est capable de former une métastase : moins d’une sur 10 000 cellules tumorales qui quittent la tumeur primitive échappe au système de défense de l’organisme et fonde une nouvelle tumeur.
Du fait de leur hétérogénéité génétique et phénotypique, les diverses cellules cancéreuses d’une même tumeur ont des capacités métastatiques variables : l’histoire naturelle d’un cancer comporte une sélection positive de sous-clones cellulaires à capacité métastasiante.
3
.
2
-
Différentes étapes de la dissémination métastatique
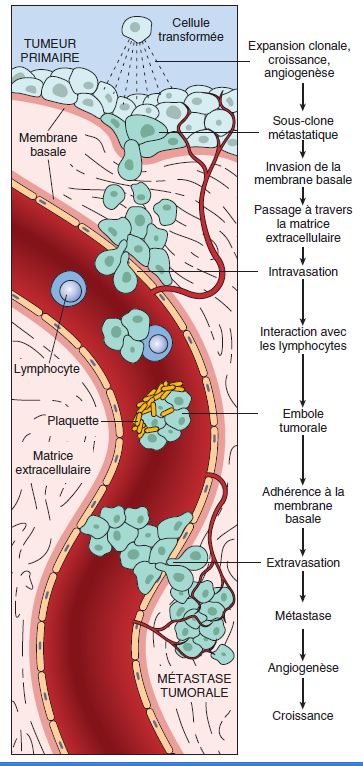
Que ce soit par voie sanguine ou lymphatique, les cellules cancéreuses qui quittent le foyer tumoral initial doivent franchir des étapes successives : chaque étape représente un obstacle que seul un petit nombre de cellules cancéreuses ayant réussi à s’adapter à un nouvel environnement réussiront à franchir.
Ces différentes étapes sont (voir figure 9.5) :
- le détachement cellulaire et l’invasion de la matrice extra-cellulaire ;
- l’intravasation : passage dans la circulation ;
- survie dans la circulation ;
- extravasation ;
- survie et prolifération dans un site étranger.
3
.
3
-
Mécanismes moléculaires impliqués dans ces différentes étapes
3
.
3
.
1
-
Détachement cellulaire et invasion de la matrice extra-cellulaire
C’est une étape limitante qui met en jeu les molécules d’adhésion (perte de l’ancrage cellulaire), les protéases extra-cellulaires (dégradation de la matrice extra-cellulaire), et des facteurs de mobilité.
L’environnement joue un rôle majeur : stroma réaction et mise en place de l’angiogenèse, prérequis indispensable à la progression tumorale.
3
.
3
.
2
-
Intravasation
Il s’agit du passage dans le courant sanguin ou lymphatique. Il se fait soit au sein de la tumeur dans les petits vaisseaux induits par l’angiogenèse qui sont très perméables, soit en périphérie de la tumeur dans les petits vaisseaux lymphatiques. Le passage des membranes basales vasculaires fait intervenir les processus déjà décrits pour l’invasion locale de la tumeur primitive.
Survie dans la circulation
Dans la circulation les cellules cancéreuses ne prolifèrent pas. Elles doivent résister à des agressions mécaniques : pression sanguine, élongation et friction dans les capillaires.
Elles ont tendance à s’agréger pour résister aux agressions (emboles néoplasiques).
De plus, les cellules cancéreuses sont en contact avec les cellules circulantes du système immunitaire (natural killer, lymphocytes T cytotoxiques) qui lysent une grande partie d’entre elles. L’agrégation plaquettaire parfois induite au contact des cellules tumorales pourrait les protéger des agressions mécaniques, les isoler des cellules cytotoxiques et favoriser leur adhésion aux parois vasculaires.
Des agrégats de cellules tumorales se bloquent dans les petits capillaires (figure 9.6).
3
.
3
.
3
-
Extravasation
Les mécanismes impliqués semblent proches de ceux mis en jeu lors de l’extravasation des leucocytes dans les sites inflammatoires :
- contact adhésif entre des motifs de la cellule cancéreuse reconnu par la E-sélectine des cellules endothéliales (roulement) ;
- deuxième contact adhésif entre l’intégrine et son ligand endothélial qui immobilise la cellule. D’autres interactions cellulaires peuvent intervenir ;
- la cellule tumorale provoque la rétraction des cellules endothéliales qui tapissent les vaisseaux, découvrant ainsi les protéines de la membrane basale. Elle se fixe ensuite à la membrane basale par l’intermédiaire de récepteurs. Puis ses enzymes dégradent les protéines et perforent la membrane basale. Des protubérances tentaculaires s’infiltrent dans la zone endommagée et la cellule tumorale s’introduit dans cet orifice tout en continuant de produire des enzymes qui lui permettent d’atteindre les couches de la matrice extra-cellulaire situées sous la couche basale et de pénétrer dans le tissu sous-jacent.
3
.
3
.
4
-
Invasion d’un nouveau territoire
L’invasion est un phénomène actif complexe par lequel les cellules tumorales qui ont quitté la circulation sanguine envahissent les tissus. C’est une étape limitante et peu de cellules y parviennent. Un écosystème favorable est indispensable à leur survie et à leur prolifération :
- nécessité de molécules d’adhésion leur permettant de s’ancrer dans le tissu ;
- nécessité de facteurs de croissance sécrétés par le milieu ;
- nécessité d’échapper à la réponse immunitaire anti-tumorale du nouveau site colonisé ;
- nécessité d’une néovascularisation pour les amas de plus de 3 mm.
À ce stade, la majorité des cellules cancéreuses meurent par apoptose, certaines restent en dormance (pas de prolifération, pas d’apoptose) ou donnent des micrométastases indétectables (équilibre entre prolifération et apoptose). Seule une minorité de cellules donnera naissance à des métastases actives détectables.
Comme au sein de la tumeur primitive, la stroma réaction et l’angiogénèse vont pouvoir jouer leur rôle. Des cellules tumorales pourront à leur tour s’échapper et former ailleurs de nouvelles métastases (figure 9.7).
3
.
4
-
Mécanismes de sélection cellulaire
La fréquence des métastases varie selon les individus et le type de prolifération. Il n’y a jamais de métastases de gliomes (système nerveux central), les métastases des carcinomes cutanés sont rares. À l’inverse, les mélanomes et certains carcinomes bronchiques sont fréquemment l’objet d’une dissémination métastatique.
Leur délai d’apparition est également très variable. Différents mécanismes sont proposés pour expliquer ces différences.
3
.
4
.
1
-
Mécanismes génétiques
La capacité d’une tumeur à faire des métastases est un caractère secondairement acquis par mutation et/ou réarrangement chromosomique. Les gènes impliqués sont encore mal connus.
- Exemple de gène suppresseur des métastases : nm23 dont le taux d’ARN est réduit d’un facteur 10 dans les lignées de mélanome induisant des métastases chez la souris par rapport aux mêmes lignées qui n’entraînent pas de métastases.
- Exemple de gène inducteur de métastases : H-ras semble souvent impliqué.
3
.
4
.
2
-
Mécanismes immunologiques
Les défenses cellulaires anti tumorales sont assurées essentiellement par :
- les lymphocytes T cytotoxiques CD8 : ils interviennent en réponse à des Ag de surface reconnus comme étrangère (Ag spécifiques de certaines tumeurs, Ag viraux, molécules du CMH modifiées) présentés en association avec les molécules de classe I du CMH (complexe majeur d’histocompatibilité) ;
- les lymphocytes natural killer (NK) responsables d’une cytotoxicité directe non restreinte par le CMH.
Les mécanismes d’échappement de la réponse immunitaire anti-tumorale sont nombreux, dont par exemple :
- la diminution de l’expression des molécules de classe I du CMH, qui limite la reconnaissance par les lymphocytes T cytotoxiques CD8 ;
- la sécrétion de cytokines immuno-suppressives par la tumeur elle-même : TGFbéta (transforming growth factor).
3
.
4
.
3
-
Autres mécanismes de sélection : pertes cellulaires
Ces pertes cellulaires peuvent être le fait :
- d’une maturation, différenciation ;
- d’une mort cellulaire (nécrose par hypoxie ou apoptose) ;
- d’un arrêt de prolifération (passage en phase G0).
3
.
5
-
Différentes voies de migration
La migration de cellules tumorales à distance du foyer primitif peut se faire par plusieurs voies, dont l’importance relative dépend beaucoup du type tumoral. Les principales voies sont lymphatiques et sanguines, mais il peut également exister une diffusion par des cavités naturelles de l’organisme (séreuses, bronches, voies urinaires, canaux biliaires, canal rachidien…).
3
.
5
.
1
-
Extension lymphatique
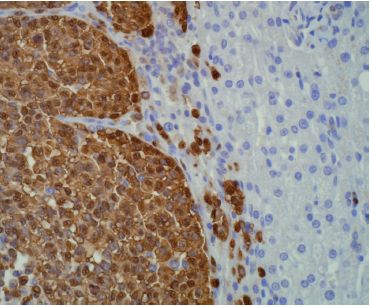
C’est la voie la plus fréquente de dissémination des carcinomes, mais peut se rencontrer également au cours des sarcomes (figure 9.8).
La métastase ganglionnaire se fait selon le drainage ganglionnaire normal de la région atteinte. Exemple : ganglions axillaires pour un carcinome mammaire du quadrant supéro-externe, ou ganglions inguinaux pour un mélanome de la face interne de la cuisse.
Le premier relais ganglionnaire du drainage lymphatique est appelé ganglion sentinelle. Depuis quelques années, des protocoles de traitement de certaines tumeurs consistent à prélever le ganglion sentinelle, puis à ne faire de curage ganglionnaire que si celui-ci est envahi par la tumeur (cf.  Métastase ganglionnaire).
Métastase ganglionnaire).
La poursuite, de proche en proche, de l’invasion des lymphatiques aboutit au déversement des cellules cancéreuses dans la circulation générale par le canal thoracique. Une étape intermédiaire fréquente est la présence d’un ganglion sus-claviculaire gauche (appelé ganglion de Troisier), dernier relais avant la circulation générale, et qui signe ainsi une diffusion prochaine à tout l’organisme du processus cancéreux.
Les cancers les plus lymphophiles sont les carcinomes, en particulier les cancers du sein, de la thyroïde, du col utérin, et les mélanomes.
La lymphangite carcinomateuse est une dissémination abondante et diffuse de cellules malignes dans les capillaires lymphatiques d’un organe entier (souvent le poumon). On l’appelle carcinomateuse car ce mode d’extension concerne essentiellement les carcinomes en particulier mammaires.
3
.
5
.
2
-
Extension hématogène
Les cellules cancéreuses, soit après passage par la voie lymphatique, soit directement par effraction de la paroi vasculaire sanguine, pénètrent les petits vaisseaux sanguins et sont entraînées par la circulation vers les organes qui filtrent le plus gros volume de sang.
Cette effraction est d’autant plus facile que les vaisseaux du stroma ont une paroi mince et qu’il existe, dans certaines tumeurs (sarcomes), des lacunes vasculaires bordées de cellules tumorales. La diffusion par voie sanguine est commune aux sarcomes, aux carcinomes et aux mélanomes.
La localisation des métastases hématogènes dépend du mode de drainage veineux de l’organe atteint par la tumeur, et du premier filtre capillaire à travers lequel passe le sang en aval. On distingue schématiquement 3 types de migration :
- type cave : les cellules drainées par le système cave supérieur (sein) ou inférieur (rein, utérus, veines sus-hépatiques) atteignent en priorité le poumon, puis tout l’organisme ;
- type porte : les cellules issues d’un cancer digestif (côlon, estomac) sont drainées par le système porte vers le foie où elles engendrent des métastases hépatiques, pouvant donner secondairement des métastases pulmonaires ou dans le reste de l’organisme ;
- type pulmonaire : les cellules circulantes à partir d’un cancer broncho-pulmonaire sont déversées dans les veines pulmonaires, puis le cœur gauche et la grande circulation, donnant des métastases ubiquitaires (os, foie, encéphale, reins, surrénales, etc.).
Toutefois la localisation des métastases dépend également d’autres facteurs que le flux sanguin. En effet, certains organes, tels les os et les ovaires, qui ne sont pas des « filtres sur la circulation » comme le poumon et le foie sont pourtant souvent siège de métastases. À l’inverse certains organes très vascularisés, tels le muscle strié, la rate et la thyroïde, ne sont presque jamais sièges de métastases.
Parmi les autres facteurs impliqués, notons l’importance de l’adressage (homing) dû à l’expression par les cellules tumorales de molécules d’adhérence qui leur permettent de se localiser spécifiquement dans certains tissus. Il est également probable que le micro-environnement spécifique à chaque tissu est plus ou moins favorable à la croissance des cellules tumorales.
Ces affinités reposent au moins en partie sur les interactions de chimiokines et de leurs récepteurs.
3
.
6
-
Aspect macroscopique des métastases hématogènes
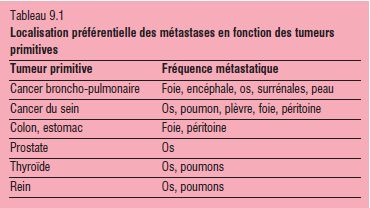
L’existence de masses tumorales multiples dans le poumon ou le foie est un argument macroscopique pour suspecter le diagnostic de métastases, alors qu’une masse tumorale unique évoque plutôt une tumeur primitive. La probabilité de l’un ou l’autre diagnostic (métastase versus tumeur primitive) repose alors sur des notions d’incidence respective de ces tumeurs selon le siège, sur des données cliniques et des données d’imagerie (ex : chez un adulte, les tumeurs primitives osseuses sont moins fréquentes que les métastases osseuses). Le plus souvent, c’est finalement l’examen anatomopathologique qui détermine la nature primitive ou secondaire d’une tumeur (tableau 9.1).
Foie
- Atteinte par la voie portale (cancers gastro-intestinaux et pancréatiques) ou par l’artère hépatique (organes génito-urinaires, poumons, sein), ainsi que mélanomes et sarcomes de tous sièges.
- Aspect : le plus souvent, nodules tumoraux multiples, blanchâtres, à centre nécrosé (les nodules sous-capsulaires apparaîtront ombiliqués), entraînant une hépatomégalie. À un stade terminal, le foie peut être entièrement tumoral (figure 9.9).
Poumons
- À partir le plus souvent du sein, du tube digestif, des bronches, du rein, de la thyroïde, de sarcomes de tous sièges…
- Aspect : le plus souvent, multiples nodules dans les 2 poumons : « lâcher de ballons » (figure 9.10). Plus rarement, masse unique, intraparenchymateuse pulmonaire ou péri- et intrabronchique, simulant un cancer broncho-pulmonaire primitif.
Os
- Les métastases osseuses se développent à partir de l’envahissement des capillaires sanguins de la moelle hématopoïétique. Les tumeurs primitives le plus souvent en cause sont : sein, poumon-bronche, prostate, rein, thyroïde ; chez le jeune enfant : fréquence des métastases osseuses de neuroblastome.
- Aspect : peuvent s’observer partout dans le squelette, souvent le rachis, et sont souvent multiples. Les métastases peuvent détruire l’os (figure 9.11), et être à l’origine d’une fracture osseuse pathologique, c’est-à-dire survenue spontanément ou lors d’un traumatisme minime. Les métastases osseuses sont le plus souvent ostéolytiques, mais peuvent aussi être ostéocondensantes ou mixtes.
Cerveau
- Les métastases cérébrales sont le plus souvent d’origine broncho-pulmonaire ou à partir d’un cancer du sein, du tube digestif ou d’un mélanome.
- Aspect : masse unique souvent à centre nécrosé ou multiples nodules dispersés.
Essaimage direct par une cavité naturelle
Il peut se produire lorsqu’une tumeur maligne s’étend jusqu’à cette cavité comme les cavités pleurale ou péritonéale, les espaces méningés, les voies urinaires, les canaux biliaires ou une cavité articulaire.
Exemples : extension péritonéale d’un carcinome ovarien, extension ovarienne d’un adénocarcinome gastrique : tumeur de Krükenberg.
Cet essaimage peut également se faire par la rupture de la tumeur dans une cavité (ex : rupture d’un sarcome digestif dans la cavité péritonéale).
3
.
6
.
1
-
Aspect microscopique des métastases
Par rapport à la tumeur primitive la morphologie peut être :
- identique ;
- moins différenciée voire dédifférenciée ;
- plus mature (rare, surtout après radiothérapie).
Une métastase peut survenir au cours de la surveillance évolutive d’une tumeur connue.
À l’inverse, la découverte d’une ou plusieurs métastases peut être révélatrice d’un cancer. Dans ce cas, la localisation et l’analyse histologique peuvent orienter la recherche de la tumeur primitive, dont l’identification est souvent utile pour les choix thérapeutiques. L’immunohistochimie est parfois également utile.
Exemples :
- une adénopathie cervicale peut révéler, entre autres tumeurs, un lymphome ou une métastase d’un carcinome épidermoïde de l’oropharynx ;
- l’expression de TTF-1 par un adénocarcinome pulmonaire est en faveur d’une origine primitive plutôt que d’une métastase, ou l’expression de la PSA au sein d’une métastase osseuse d’un adénocarcinome est en faveur d’une origine prostatique.
3/3






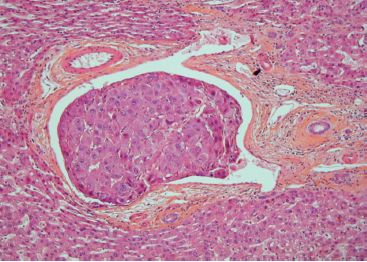
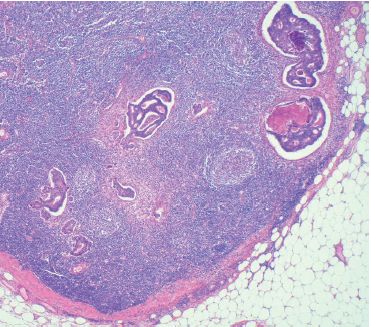
 Métastase ganglionnaire
Métastase ganglionnaire