Introduction
La maladie cancéreuse se caractérise par l’envahissement progressif de l’organe d’origine, puis de l’organisme entier, par des cellules devenues peu sensibles ou insensibles aux mécanismes d’homéostasie tissulaire et ayant acquis une capacité de prolifération indéfinie (immortalisation).
Ces cellules tumorales dérivent dans la grande majorité des cas d’une seule cellule (monoclonale). Les particularités des cellules tumorales sont liées à l’accumulation d’altérations de leur génome (génotype). Ces altérations sont le plus souvent acquises au cours de la genèse tumorale, mais certaines peuvent être d’origine héréditaire (prédispositions familiales).
Les clones tumoraux peuvent perdre ou conserver certaines caractéristiques morphologiques et fonctionnelles des cellules originelles, ou en acquérir de nouvelles (variabilité du phénotype des sous-clones).
Ces modifications vont s’inscrire à la fois dans le noyau, dans le cytoplasme et sur la membrane des cellules pathologiques.
1
-
Bases moléculaires du cancer
Un néoplasme est la conséquence d’altérations successives du génome des cellules tumorales, qui perturbent de façon permanente l’homéostasie tissulaire (figure 8.1).
Dans la cellule cancéreuse, il y a rupture permanente de l’équilibre entre les signaux intracellulaires :
- activation de voies stimulatrices ;
- suppression de voies inhibitrices.
La coexistence de plusieurs événements est nécessaire à la transformation cancéreuse. L’activation de nouveaux oncogènes se poursuit tout au long de la progression tumorale : processus multi-étapes.
1
.
1
-
Différents agents de l’environnement conduisent au développement d’un cancer
-
Agents initiateurs : ils induisent une lésion définitive de l’ADN (ex : mutation, cassure). Souvent, ces carcinogènes sont activés par des réactions métaboliques.
Exemples :
- carcinogènes chimiques : hydrocarbures polycycliques aromatiques (pétrole, tabac), amines aromatiques (colorants, industrie du caoutchouc), 2-naphtylamine, agents alkylants, aflatoxine b1 ;
- virus (hépatite B, d’Epstein-Barr, etc.) ;
- radiations.
-
Agents promoteurs : ils favorisent l’expression d’une lésion génétique, préalablement induite par un agent initiateur. Ils n’induisent pas de lésions de l’ADN. Le temps écoulé entre l’initiation et l’apparition des tumeurs est réduit en présence d’agents promoteurs.
Exemples :
- esters de phorbol (TPA) (huile de croton) ;
- hormones : œstrogènes (cancer du sein) ;
- nutrition : alcool (tumeurs ORL), graisses alimentaires (cancers coliques) ;
- schistosomiase et cancer de la vessie.
1
.
2
-
Les trois familles de gènes impliquées dans la cancérogenèse
Oncogènes
Certains virus animaux sont capables d’induire des tumeurs (ex : sarcome de Rous du poulet, découvert en 1911). Les propriétés transformantes de ces virus sont dues à la présence dans leur génome de séquences particulières, les oncogènes viraux (v-onc).
Ces gènes renferment à eux seuls toute l’information pour l’activité transformante. Ces gènes sont des formes altérées de gènes normaux d’origine cellulaire, les proto-oncogènes, capturés par les rétrovirus au cours de leur réplication.
Les proto-oncogènes sont conservés dans toutes les espèces (de l’insecte à l’homme) et jouent un rôle essentiel dans des étapes clés de la régulation de l’embryogénèse ou de la croissance cellulaire ou tissulaire. Ces gènes normaux lorsqu’ils sont remaniés et/ou sur-exprimés deviennent des oncogènes (c-onc). Ils peuvent induire l’apparition et/ou le développement d’une tumeur.
Les oncogènes sont schématiquement classés en :
- gènes immortalisants (ex : c-myc) codant pour des protéines nucléaires se liant à l’ADN ;
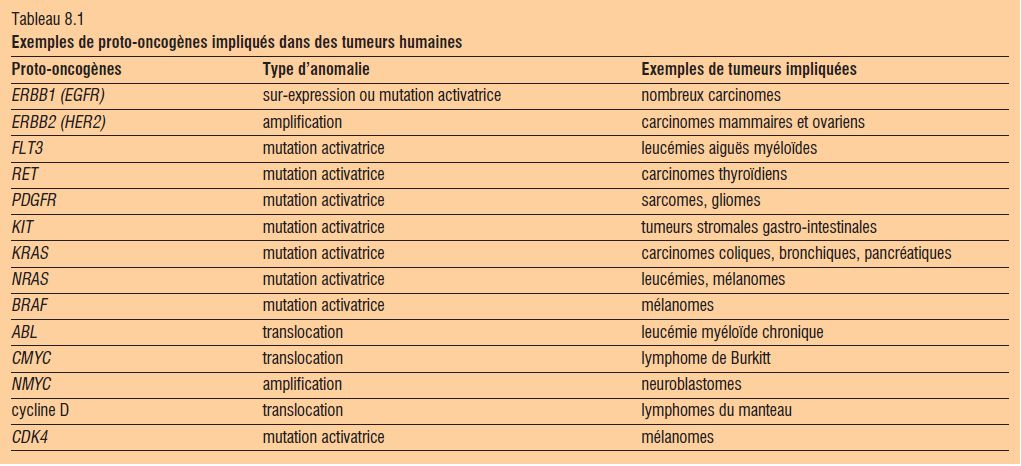
- gènes transformants (ex : KRAS, RET, KIT) (tableau 8.1).
Gènes suppresseurs
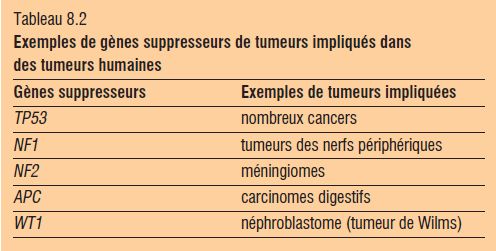
Les gènes suppresseurs de tumeur (ou anti-oncogènes) sont des inhibiteurs de la croissance cellulaire. L’inactivation du produit de ces gènes par perte de fonction biallélique se traduit par l’absence d’un signal de non-prolifération cellulaire : il s’agit d’une perte de fonction.
Le premier gène suppresseur de tumeur décrit est le gène Rb du rétinoblastome. Le gène suppresseur de tumeur le plus souvent impliqué est la TP53, avec des mutations somatiques dans de très nombreux cancers et des mutations germinales dans le syndrome de Li-Fraumeni.
Les oncogènes et gènes suppresseurs de tumeur codent pour des protéines qui interviennent dans les grandes fonctions cellulaires : signalisation, prolifération, différenciation, cycle, apoptose (tableau 8.2).
Gènes de maintien de l’intégrité (care takers)
Des agents pathogènes (rayons X, UV, hydrocarbures) peuvent entraîner des lésions ponctuelles de l’ADN (cassure d’un brin, délétion, mutation d’une base). Les gènes de maintien de l’intégrité codent pour un complexe multi-fonctionnel capable de surveiller l’intégrité du génome (MSH2, MSH6.). En cas d’anomalies, différents systèmes de réparation sont mis en place (BRCA1, rad50, MLH-1). S’ils échouent, la cellule lésée meurt par apoptose.
L’altération des 2 allèles de ces gènes conduit à une susceptibilité accrue aux cancers, par instabilité génétique (accumulation de mutations conduisant à l’activation d’oncogènes ou à l’inactivation d’anti-oncogènes).
Des mutations impliquant ces trois familles de gènes sont présentes dans la majorité des cancers. Ces lésions peuvent être d’origine environnementale, sous l’effet notamment d’agents initiateurs, ou au contraire d’origine génétique.
1
.
3
-
Contrôle de l’expression et/ou de l’activation
Des proto-oncogènes, des gènes suppresseurs de tumeurs et des gènes du maintien de l’intégrité du génome.
Plusieurs mécanismes peuvent être responsables de l’expression et/ou de l’activation des gènes impliqués dans la tumorigenèse. Ces mécanismes ne sont pas mutuellement exclusifs.
Mutations ponctuelles, délétions, insertions (figure 8.2)
Pour les proto-oncogènes, un seul événement génétique est généralement suffisant pour l’activation (dominant). Pour les gènes suppresseurs de tumeurs et les gènes de surveillance du génome, un double événement est nécessaire pour que le gène soit inactivé au niveau des 2 allèles (récessif).
Amplification génique
Ce phénomène correspond à une multiplication du nombre de copies d’un gène. Il en résulte une augmentation de son expression. Il serait surtout tardif dans l’oncogenèse (figure 8.3).
Réarrangements chromosomiques
Les translocations peuvent aboutir soit à l’expression d’une protéine chimérique résultant de la fusion entre deux gènes, soit à l’hyperexpression d’un oncogène en raison de la transposition de la région codante de celui-ci à proximité de séquences régulatrices d’autres gènes.
Exemple 1 :
Dans la leucémie myéloïde chronique (LMC) la translocation réciproque entre les chromosomes 9 et 22 produit un chromosome 22 raccourci : le chromosome de Philadelphie. Cette translocation aboutit à un gène de fusion bcr/c-abl codant pour une tyrosine kinase activée. Il existe actuellement une molécule thérapeutique capable de bloquer spécifiquement la tyrosine kinase activée par cette translocation. Grâce à cette thérapeutique (Imatinib), le pronostic de la LMC a été transformé.
Exemple 2 :
Dans le lymphome de Burkitt, la translocation (8 ;14) aboutit à la surexpression de l’oncogène c-myc (chromosome 8) qui se retrouve sous le contrôle du promoteur de la chaîne lourde des immunoglobulines (chromosome 14).
Délétions chromosomiques et remaniements chromosomiques complexes
Il peut en résulter une perte de fonction d’un gène suppresseur de tumeur. Cette perte de fonction peut être récessive (ex : Rb) ou dominante (ex : APC).
Mécanismes épigénétiques
L’hypo- ou l’hyper-méthylation de gènes ou de leurs séquences régulatrices peut moduler leur transcription, alors que la séquence d’ADN est normale. On parle de mécanismes épigénétiques par opposition aux mécanismes génétiques c’est-à-dire avec altération de l’ADN.
1
.
4
-
Facteurs favorisant l’activation
Des proto-oncogènes, des gènes suppresseurs de tumeurs et des gènes du maintien de l’intégrité du génome.
Facteurs héréditaires
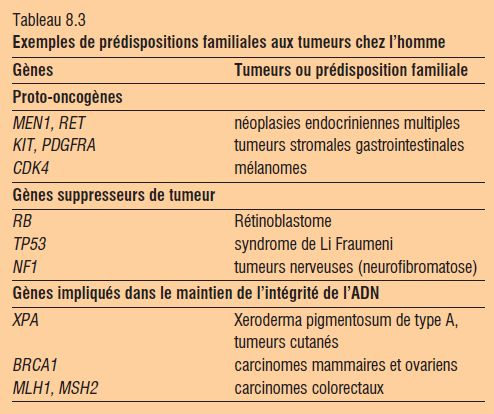
Ces facteurs génétiques sont responsables de prédispositions familiales aux cancers. La transmision peut être dominante ou récessive, et la pénétrance variable. Les prédispositions génétiques aux cancers sont nombreuses, et les prédispositions monogéniques sont les mieux connues (tableau 8.3).
Facteurs viraux
- Rétrovirus à ARN. Certains rétrovirus sont directement oncogéniques, mais il n’en existe d’exemple connu que chez l’animal. Chez l’homme, le rétrovirus HTLV1 s’intègre au hasard dans le génome, il est dépourvu d’oncogène mais contient un gène transactivateur (tax) capable d’activer les gènes de l’interleukine 2 et de son récepteur dans les lymphocytes T.
- Virus oncogènes à ADN : ils ne renferment pas d’oncogène de type v-onc. Le plus souvent ils semblent agir par trans-activation de gènes cellulaires (mutagénèse insertionnelle).
- D’autres virus agissent de façon plus indirecte.
Exemple :
Le virus d’Epstein-Barr induit chez les sujets immunodéprimés (VIH, endémie paludique, transplantés) une intense prolifération polyclonale des lymphocytes B infectés et augmente ainsi le risque de survenue de translocations chromosomiques. Au cours de ces translocations somatiques peuvent se produire des juxtapositions accidentelles de gènes, capables d’activer des proto-oncogènes : la translocation t(8 ;14) : juxtaposition de c-myc et du gène de la région constante des immuno-globulines.
Facteurs physiques
- Les radiations ionisantes favorisent les mutations et les cassures chromosomiques.
- Les ultraviolets entraînent des cassures de l’ADN, impossibles à réparer chez les malades atteints de xeroderma pigmentosum (anomalie génétique) ; d’où la survenue de multiples cancers cutanés.
Facteurs chimiques
Il en existe de nombreux exemples :
- le tabac ;
- l’aflatoxine induit des mutations très spécifiques du gène P53 : carcinogène hépatique ;
- les cancers professionnels dus aux dérivés du benzopyrène.
Progression tumorale et cycle cellulaire
La progression du cycle cellulaire est finement régulée par des « points de contrôle », qui permettent notamment une régulation de la vitesse de prolifération et un maintien de l’intégrité du génome cellulaire. Dans beaucoup de tumeurs, ces points de contrôle sont altérés.
En cas de cancer, les signaux extra-cellulaires ou intracellulaires reçus par la cellule vont être capables d’activer les complexes cycline/cdk ou d’altérer l’activité des inhibiteurs (p21, p15, p16). Le résultat sera la levée du verrou Rb et l’entrée de la cellule en cycle.
Exemple :
Le cancer du col de l’utérus : les papillomavirus humains (HPV) sont des petits virus à ADN double brin capables d’infecter les tissus épithéliaux, le plus souvent de façon asymptomatique. Certains types d’HPV dits à haut risque (HPV 16, 18) sont associés au cancer du col de l’utérus. On sait désormais que ce virus s’intègre dans le génome de la cellule hôte où il code pour des protéines virales (e6 et e7) capables de se lier et de dégrader respectivement p53 et Rb, ce qui entraîne une levée du verrou du cycle cellulaire.
 Rappel sur le cycle cellulaire normal .
Rappel sur le cycle cellulaire normal .
1
.
5
-
Progression tumorale et apoptose
La cellule cancéreuse devient résistante à l’apoptose.
L’apoptose est impliquée dans le contrôle de l’homéostasie cellulaire, et est sous le contrôle de nombreux gènes :
- gènes pro-apoptotiques ; exemple : P53, MYC (voir schéma du cycle cellulaire) ;
- gènes de survie ou anti-apoptotiques ; exemple : BCL-2 ;
En cas de lésion de l’ADN, le gène P53 est activé, permettant, par l’intermédiaire de p21, l’arrêt du cycle cellulaire et la réparation des lésions de l’ADN ou l’activation de l’apoptose. Il existe des anomalies du gène p53 dans {2/3} des cancers (mutations, délétions) entraînant la suppression du point de vérification de G1 et donc de la voie apoptotique en cas d’instabilité génomique ou d’anomalies chromosomiques.
Dans le lymphome folliculaire, la translocation t(14 ;18) aboutit à la juxtaposition du gène BCL-2 avec le locus de la chaîne lourde des immunoglobulines et entraîne la surexpression de la protéine bcl-2. L’accumulation de cette protéine anti-apoptotique augmente la survie des lymphocytes B, ce qui accroît le risque d’acquisition de nouvelles anomalies génétiques conduisant au développement du lymphome folliculaire.
1
.
6
-
Progression tumorale et immortalité : la cellule cancéreuse a une prolifération illimitée
Les cellules normales sont programmées pour un nombre limité de dédoublements (environ 60–70 in vitro). Aux extrémités des chromosomes se trouvent des séquences répétitives (télomères) qui sont érodées à chaque réplication de l’ADN. Leur disparition induit un arrêt de la prolifération (G0).
Dans la plupart des cellules tumorales, il existe un maintien des télomères au cours des réplications successives. Ceci est dû à la surexpression des télomérases, qui sont les enzymes capables d’ajouter des séquences répétées à l’extrémité des chromosomes.
1/5








 Rappel sur le cycle cellulaire normal
Rappel sur le cycle cellulaire normal