
Cas clinique 2
Scénario clinique
Observation
Un patient de 45 ans est adressé par son médecin traitant aux urgences pour hyperthermie, dyspnée et toux évoluant depuis plus de 72 heures malgré un traitement par Augmentin et Solumédrol. À l’examen, on note : température à 39,5 °C, fréquence respiratoire à 35/min, pression artérielle à 90/50 mmHg, fréquence cardiaque à 130/min. À l’auscultation pulmonaire, on note des râles crépitants dans les 2 champs mais ceux-ci prédominent à gauche où on perçoit aussi un souffle tubaire. La percussion montre une matité à gauche avec augmentation de la transmission des vibrations vocales. La toux est grasse mais peu productive. La saturation percutanée en oxygène est mesurée à 60 % en air ambiant. Les bruits du cœur sont réguliers sans souffle audible. Il n’y a pas de signe d’insuffisance cardiaque droite ou gauche et l’examen des membres inférieurs est sans particularité. Les examens complémentaires montrent les résultats suivants :
– ECG : rythme régulier et sinusal sans troubles de la conduction ;
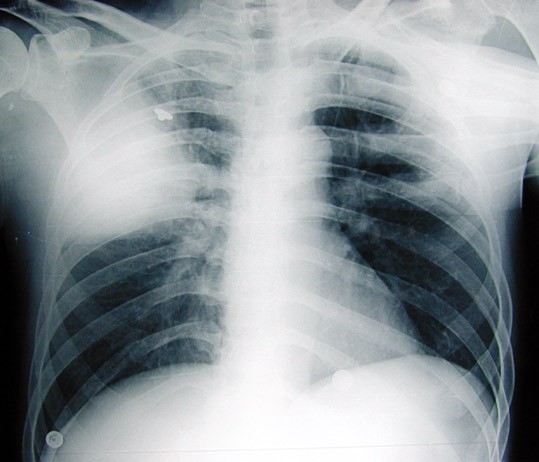
– radiographie du thorax : voir la figure 1 ;
– biologie : Na = 126 mmol/L, K = 4,8 mmol/L, Cl = 91 mmol/L, protéines = 73 g/L, créatinine = 111 µmol/L, urée = 12 mmol/L, glycémie = 8,2 mmol/L, CPK = 1 295 UI/L, ALAT = 88 UI/L, ASAT = 58 UI/L, bilirubine totale = 19 µmol/L, CRP = 350 mg/L, leucocytes = 17 800/mm3, hématies = 4 000 000/mm3, hémoglobine = 12,8 g/100 mL, hématocrite = 37,6 %, plaquettes = 289 000/mm3 ;
– gaz du sang (sous O2 à 6 L/minute) : pH = 7,53, PaO2 = 45,7 mmHg, PaCO2 = 27 mmHg, SaO2 = 83,8 %, bicarbonates = 24 mmol/L.
Cas clinique 2
Question 1
Quel diagnostic évoquez-vous ?
EN SAVOIR PLUS
|
1) Les types de dyspnée. Orthopnée apparaît ou s’aggrave en position couchée. Origine cardiaque (insuffisance ventriculaire gauche) Polypnée augmentation de la ventilation minute Hypopnée diminution de la ventilation minute Tachypnée augmentation de la fréquence respiratoire > 25 c/min Bradypnée diminution de la fréquence respiratoire < 15 c/min Dyspnée de Cheyne-Stockes rythme périodique et alternance de respirations profondes et d’apnée. Origine métabolique ou centrale Dyspnée de Kussmaul rythme lent, ample avec égalisation des deux temps. Origine métabolique (acidose) La dyspnée est un symptôme consécutif à la perception consciente d’une gêne respiratoire. La dyspnée peut être à dominante inspiratoire: elle évoque une origine haute, ou expiratoire: elle évoque une origine bronchique. 3) Signes cliniques d’une IRA. Signes d’hypoxémie Cyanose Tachycardie Troubles de la conscience, tardifs et graves Signes d’hypercapnie Troubles de la conscience précoces, flapping Hypertension Hypercrinie (sueurs, hypersialorrhée, encombrement) Signes d’augmentation du travail respiratoire et de fatigue Tachypnée = 35/min Tirage Dépression inspiratoire des creux sus-claviculaires et des espaces intercostaux Encombrement, bronchospasme Signes en rapport avec une défaillance viscérale secondaire Cœur pulmonaire aigu Foie cardiaque aigu Dilatation gastro-intestinale aiguë Insuffisance rénale secondaire Signes en rapport avec la cause de l’IRA Infectieuse Cardiovasculaire Mécanique 3) Critères de gravité d’une IRA (l’existence d’un seul de ces signes de gravité conduit à demander l’hospitalisation en milieu de réanimation). 1. Le terrain Insuffisance respiratoire chronique et oxygénothérapie à domicile Insuffisance cardiaque antérieure Tare (éthylisme, diabète, immunodépression…) 2. La clinique Troubles de la conscience et flapping trémor État de choc Retentissement viscéral majeur (oligurie, foie cardiaque aigu, dilatation gastro-intestinale aiguë) 3. La gazométrie Instabilité de la PaCO2 pH inférieur à 7,20 PaO2 inférieure à 60 mmHg, malgré l’administration d’oxygène à fort débit |
Question 2
Quels sont les facteurs de gravité chez ce patient ?
Question 3
Quelle est votre prise en charge symptomatique immédiate ?
Question 4
Quelles sont les autres examens complémentaires à réaliser en urgence ?
Question 5
Quelle antibiothérapie instituez-vous en urgence ? Justifiez votre réponse.
EN SAVOIR PLUS
|
(Renvois au livre : Chapitre 1, p17-24 : Conduite à tenir devant une insuffisance respiratoire aiguë) Manœuvres de désobstruction des voies aériennes hautes Les insuffisances respiratoires aiguës d’origine haute, laryngotrachéale, peuvent imposer un geste immédiat de tentative de désobstruction ou de sauvetage si l’obstacle est total, et en présence de signes d’épuisement musculaire respiratoire (tachypnée) ou d’hypoxémie (cyanose) faisant craindre un arrêt circulatoire hypoxique. Ces gestes sont dangereux et de réalisation difficile et il n’est pas documenté si l’une de ces techniques est supérieure aux autres. Si l’obstacle reste partiel, il faut éviter toute manœuvre, y compris l’examen local, qui risquerait d’aggraver la situation. Il faut tenter de calmer le malade, mettre en place une oxygénothérapie, et un aérosol humidificateur, administrer un corticoïde par voie inhalée, injecter un corticoïde d’action rapide par voie IVD ou IM (méthylprednisolone: 1-2mg/kg) et hospitaliser d’urgence le malade. Ouverture forcée de la bouche et nettoyage au doigt L’ouverture forcée s’effectue à l’aide du pouce et de l’index, introduits au coin de la bouche. L’index prend appui sur le maxillaire supérieur, et le pouce, croisé au-dessus de l’index, appuit sur le maxillaire supérieur en forçant l’ouverture. De l’autre main, on tente au doigt (ou mieux à la pince) d’extraire le corps étranger. Claque dorsale Le sujet étant couché sur le ventre, on surélève son bassin d’un bras glissé sous l’abdomen, de façon à incliner le tronc à environ 45°; de la paume de l’autre main, on administre dans le dos, entre les omoplates, une série de claques vigoureuses. L’enfant peut être suspendu par les pieds et la force des claques doit être dosée. Manœuvre de Heimlich Le sujet est en position assise ou debout. Positionné derrière lui, on enlace la partie haute de l’abdomen. On place les deux mains sous l’appendice xiphoïde, l’une poing fermé, paume vers le bas et l’autre couvrant le poing. En profitant d’une tentative d’expiration du malade, on comprime fortement l’abdomen en orientant la poussée de bas en haut. On répète au besoin l’opération. Cette manœuvre n’est raisonnablement praticable que chez l’adulte conscient, le petit adulte ou l’enfant. Une variante peut être effectuée chez le malade inconscient allongé sur le sol en décubitus dorsal. Les mains sont positionnées comme pour un massage cardiaque mais au niveau de l’épigastre. L’appui se fait vers l’arrière et le haut. Intubation Elle est toujours très difficile dans ces circonstances et, en l’absence d’expérience, il faut mieux se contenter d’une oxygénothérapie à fort débit et d’une ventilation au masque et ballon d’Ambu. Trachéotomie Elle n’est raisonnablement praticable qu’en milieu hospitalier; si l’urgence l’impose, on peut, dans le cadre des équipes de secours entraînées, introduire dans la trachée un cathéter de gros calibre à travers la membrane cricothyroï dienne, raccorder ce cathéter à une seringue de 20mL sans son piston, intro duire une sonde d’intubation dans la seringue, et gonfler le ballonnet. Cette technique permet une oxygénation et une ventilation temporaire de sauvetage. Pour en savoir plus Le contrôle des voies aériennes. In: Safar P, Bircher N, eds. La réanimation cardiorespiratoire et cérébrale d’urgence. Paris: Arnette, 1989: 17-59. Oxymétrie de pouls L’oxymétrie de pouls (SpO2) permet un monitorage simple, fiable, continu mais indi rect de la SaO2. C’est une méthode de surveillance irremplaçable des états de détresse respiratoire et de l’oxygénothérapie. Elle est indiquée chez tous les malades. La mesure, non invasive, transcutanée s’effectue avec un capteur positionné au niveau d’un doigt, mais elle est aussi possible sur un orteil ou le lobe de l’oreille. Elle utilise une méthode spectrophotométrique techniquement difficile du fait de la nécessité de séparer l’absorption de la lumière due au sang artérialisé de l’absorption due aux tissus mous, au sang veineux et au sang capillaire. Le principe de la mesure de la SpO2 est de considérer que l’absorption due aux tissus mous et au sang veineux est stable et que celle due au sang artérialisé est variable avec l’onde pulsatile. L’utilisation de diodes émettrices de lumière dans des longueurs d’onde de 650nm et 850nm rend la mesure suffisamment précise pour une utilisation en monitorage à la condition que l’onde pulsatile soit correctement identifiable. Pour des SaO2 supérieures ou égales à 90%, la précision de la mesure (évaluée par le coefficient de variation: déviation standard/moyenne) est de l’ordre de ± 1%, avec un biais (différence constante et systématique de mesure en mesure) inférieur à 2%. La mesure est moins bonne quand la SaO2 est inférieure à cette valeur. Un biais de 4% est observé entre 90 et 75% de SaO2 et peut atteindre 15% pour des SaO2 inférieures à 50%. Pour des valeurs supérieures ou égales à 90%, la SpO2 n’est pas un monitorage indirect de la PaO2: une SpO2 de 95% peut correspondre à des PaO2 comprises entre 60 et 120mmHg, du fait de la forme particulière de la courbe de disso ciation. En revanche, pour des SpO2 inférieures à 90%, même si la précision de la mesure diminue, la relation entre les variations de PO2 et de SO2 est bonne. Ventilation manuelle au masque Un ventilateur manuel, type Ambu, est composé d’un ballon «autoremplisseur» semi-rigide, d’une valve bidirectionnelle évitant la réinspiration du gaz insufflé, et d’un masque facial étanche (Fig.1.5). Le gaz insufflé est enrichi en oxygène par le raccord du ballon à une source dont le débit ne doit pas être excessif (10L/min d’O2) pour ne pas rendre la vidange du ballon difficile. La réalisation d’une ventilation manuelle est une technique élémentaire de survie, qui doit être connue de tous pour être pratiquée lors des arrêts car diaques ou respiratoires. La ventilation par un masque est moins efficace que celle délivrée par une sonde d’intubation ou un bouche à bouche. Néan moins, elle peut être momentanément suffisante si quelques règles simples sont respectées. La mise en œuvre d’un ventilateur manuel dépend du nombre d’opérateurs. Un seul opérateur aura des difficultés à accomplir correctement les trois actions que l’on doit réunir pour optimiser la ventilation manuelle: l’ouver ture des voies aériennes, l’application du masque, et l’insufflation. L’ouverture des voies aériennes est obtenue d’abord en libérant la cavité buccale et les voies aériennes de tous les corps étrangers, ensuite en indui sant une légère hyperextension de la tête tout en soulevant le menton avec deux à trois doigts. En cas de doute sur l’intégrité du rachis cervical, le maxil laire inférieur est simplement subluxé prudemment. Le masque doit être apposé d’une façon étanche, couvrant la bouche, le nez, étroitement plaqué sur les joues. Chaque insufflation, d’environ 800 à 1200mL (10 à 15mL.kg-1 chez l’adulte), est effectuée lentement en 1,5 à 2 secondes. L’insufflation sui vante n’est exécutée qu’après la fin complète de l’expiration (3 à 4 secon des). Une ventilation plus rapide risque grandement d’induire des fuites par les bords du masque et/ou une surpression pharyngée avec l’ouverture du sphincter supérieur de l’œsophage et ainsi d’entraîner une insufflation gas trique. La fréquence de la ventilation est de 10 à 12 cycles par minute. Dans les arrêts cardiaques, les compressions thoraciques externes doivent être interrompues pendant l’insufflation. L’alternance de compressions thoraci ques et d’insufflations peut être de 5 compressions pour 1 insufflation ou de 15 compressions pour 2 insufflations. L’efficacité de la ventilation doit être contrôlée par la surveillance des mouvements thoraciques, à l’insuffla tion et à l’expiration. À la fin de l’insufflation, le ballon doit être relâché soudainement. La réalisation de la ventilation manuelle est facilitée par la présence de plusieurs opérateurs, l’un tenant le masque, un deuxième pressant le ballon, et éventuel lement un troisième exerçant une pression cricoïdienne (manœuvre de Sellick) pour comprimer l’œsophage. Quand l’opérateur est seul, dans un premier temps la main droite (ou gauche si l’opérateur est gaucher) place le masque sur le visage, les derniers doigts de la main gauche soulèvent la mandibule pour ouvrir les voies aériennes. Dans un deuxième temps, le pouce et l’index de la main gauche se saisissent du masque, qu’ils appliquent fermement sur le visage. Dans un troisième temps, la main droite comprime le ballon. Oxygénothérapie dans l’IRA L’oxygène est un médicament qui obéit à des règles de prescriptions. L’oxy génothérapie consiste à enrichir en oxygène le mélange inhalé, de 21% (air ambiant) jusqu’à 100% (oxygène pur). Indications L’oxygénothérapie est indiquée dans toutes les anomalies du transport ou de l’utilisation de l’oxygène: insuffisance respiratoire aiguë, état de choc, anémie aiguë, anomalie de l’hémoglobine, anomalie de l’utilisation cellulaire de l’oxygène. L’objectif de l’oxygénothérapie est de corriger l’hypoxémie artérielle pour in fine assurer une oxygénation tissulaire correcte. Elle est formellement indiquée chez tout malade ventilant à l’air ambiant et dont la SaO2 est inférieure à 90% et la PaO2 inférieure à 60mmHg. Contre-indications Il n’y a pas de contre-indication à l’oxygénothérapie. L’hypercapnie, quand elle s’aggrave sous oxygénothérapie, ne rend nécessaire qu’une surveillance et une conduite à tenir particulière, notamment lors de la décompensation aiguë des bronchopneumopathies chroniques. Méthodes d’administration L’oxygène est prescrit toujours en continu, par l’intermédiaire de lunettes, d’une sonde nasale, d’un masque, d’une technique de ventilation mécani que. Sauf en ventilation mécanique, la concentration en oxygène administrée (FIO2) n’est pas strictement contrôlée et dépend du débit et de la ventilation minute du malade, le degré d’humidification est très faible. Lunettes confortables, elles ne permettent pas des FIO2 élevées du fait de la ventila tion par la bouche. Elle assèchent les fosses nasales. Elles sont réservées aux situations cliniques stables nécessitant un petit débit d’oxygène. Sonde nasale Elle permet des FIO2 plus élevées si l’extrémité de la sonde est bien posi tionnée au-dessus de la glotte. Elle doit être introduite dans une narine et enfoncée jusqu’à ce que le malade tousse, elle est alors retirée de 2cm de façon que l’extrémité distale de la sonde soit dans l’oropharynx. On peut aussi introduire une longueur de sonde égale à la distance qui sépare la narine du lobe de l’oreille. La sonde nasale assèche l’oropharynx et la glotte et irrite les fosses nasales. Masques Ils permettent les FIO2 les plus élevées et les moins mal contrôlées. L’humi dification est bonne. Ils doivent être utilisés dans les situations instables nécessitant des FIO2 importantes. On distingue les masques a venturi, per mettant des FIO2 de l’ordre de 40 à 60% et les masques à haute concen tration avec ballon réservoir, permettant des FIO2 supérieures à 60% voire égales à 1. Surveillance Elle s’effectue principalement par l’oxymétrie de pouls (SpO2) dont la fiabilité est largement suffisante en pratique. Un contrôle gazométrique est utile avant la prescription d’oxygène pour disposer d’un gaz du sang de référence, et dans les deux heures qui suivent le début de l’administration pour contrôler le résultat sur la PaO2 et la PaCO2. Arrêt L’oxygénothérapie est arrêtée dès que la situation clinique le permet et après avoir contrôlé la stabilité de la SpO2 supérieure à 92% sans oxygène. Cas particulier Dans les décompensations respiratoires aiguës des bronchopneumopathies chroniques, il existe un risque d’aggraver l’hypercapnie. Ce risque est limité et ne doit ni contre-indiquer, ni retarder, ni faire prescrire en discontinu, ni faire interrompre l’oxygénothérapie, qui est indiquée dans les même conditions que dans les autres insuffisances respiratoires aiguës. Les mécanismes de l’augmentation de la PaCO2 sous oxygénothérapie sont multiples. L’hypoven tilation, du fait de la disparition du stimulus hypoxique, est le plus classique. Elle est néanmoins transitoire et modérée. Elle est limitée par la stimulation du centre inspiratoire central quand la PaCO2 augmente et quand le pH dimi nue. Deux autres mécanismes sont souvent dominants, la modification des rapports VA/Q avec augmentation de l’effet espace mort et de l’effet Haldane: l’oxyhémoglobine est moins apte à transporter du CO2 que l’hémoglobine réduite, ce qui augmente la fraction dissoute du CO2 et donc la PaCO2. La correction de l’hypoxémie nécessite en règle des débits faibles, de 2 à 3litres, à la sonde nasale, et quelques précautions. Elle nécessite au préala ble un test à l’oxygène (Fig.1.6). Un test à l’oxygène est réalisé lors du début de l’oxygénothérapie, en deux temps. Il consiste en l’administration continue d’oxygène par une sonde nasale à un débit suffisant pour obtenir une PO2 au moins égale à 60 mmHg et une saturation au moins égale à 92%. Après deux heures, un gaz du sang est pratiqué et trois situations sont possibles: dans la situation la plus favorable, l’hypoxémie est corrigée, la PO2 est supérieure à 60mmHg, la PaCO2 n’a pas augmenté: l’oxygénothérapie et le traitement médical doivent être continués; à l’opposé, après deux heures d’oxygène, il apparaît difficile de corriger l’hypoxémie. La PO2 reste inférieure ou égale à 60mmHg et la PaCO2 aug mente d’une manière importante et devient supérieure à 80mmHg. Dans ces conditions, il faut recourir à la ventilation mécanique en priorité non invasive; très fréquemment, la situation au terme des deux heures est intermédiaire: l’hypoxémie est corrigée mais la PaCO2 a augmenté. Il faut continuer à observer le malade pendant une période de douze heures: si la PaCO2 est stable (elle augmente de moins de 10mmHg durant cette période), le traitement médical peut être continué. À l’inverse, si la PaCO2 est instable, augmente de plus de 10mmHg durant cette période ou dépasse 80mmHg, le recours à la ventilation mécanique sera nécessaire. Pour en savoir plus Bateman NT, Leach RM. ABC of oxygen. Acute oxygen therapy. Br Med J 1998; 317: 798-801. Hapiro AB, Harrison RA, Cane RD, Kowlovski-Templin R.Hypoxémie et oxy génothérapie. In: Gaz du sang, applications cliniques. Paris: Frison-Laroche, 1992: 103-36. |