3.
1.
3 - Mécanisme de prise
La pâte obtenue durcit spontanément à l’air.
On pensait que le durcissement était dû au groupement ortho-méthoxy-phénol, car effectivement le gaïacol et le méthyl-gaïacol sont susceptibles par mélange avec de l’oxyde de zinc de donner des produits durcissant dans le temps.
La présence d’eau est indispensable à la réaction. Le durcissement n’a pas lieu en l’absence d’humidité. C’est une réaction de poudre avec un liquide. Ce sont donc les parties superficielles de la poudre qui réagissent alors que le coeur n’est pas modifié. Le mélange de la poudre et du liquide pour obtenir un ciment convenable varie en fonction de la granulométrie.
Il faut incorporer beaucoup plus de poudre que l’on peut le prévoir d’après la réaction théorique. Elle est due à la réaction des groupements phénol avec l’oxyde de zinc, tandis que la chélation se produit entre les (2) groupements méthoxy et l’atome de zinc central.
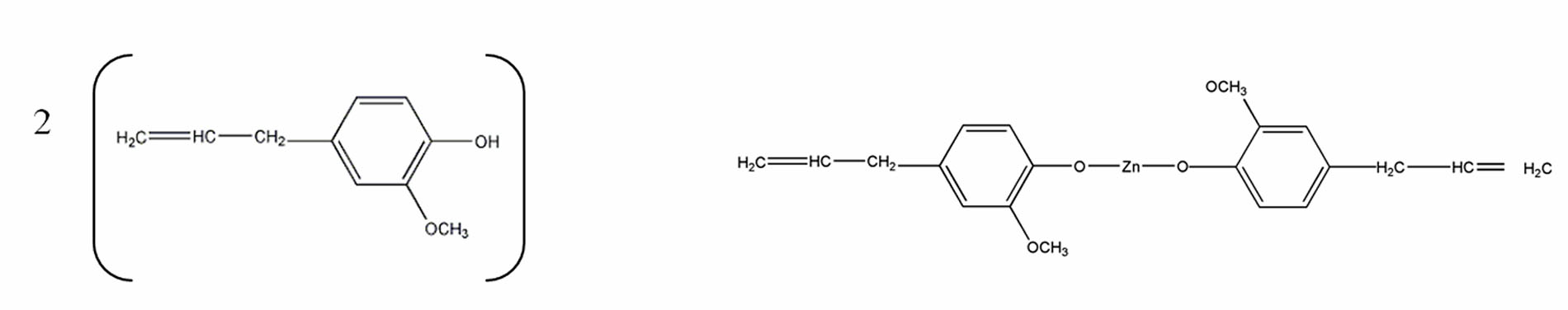
Réaction eugénol – oxyde de zinc.
La réaction est une chélation.
Le zinc fixe 2 molécules d’eugénol qu’il relie.
(EUGENOL)2 + ZnO + H2O → EUGENOLATE DE ZINC + H2O
En clinique, le rapport liquide/poudre est de 4/1 ou 6/1. La résistance mécanique varie avec la quantité de poudre incorporée, selon un facteur de 1 à 6.
3.
1.
4 - Facteurs influençant la prise
Humidité : la présence d’eau est indispensable au démarrage de la réaction.
L’eau, produit de la réaction, l’accélère à son tour.
Granulométrie de la poudre : une granulométrie fine diminue le temps de prise (diminution des interfaces poudre-liquide).
Etat de fraîcheur de l’eugénol : l’eugénol étant susceptible de subir des phénomènes d’oxydation (flacon opaque), de polymérisation et d’isomérisation.
Température : le temps de prise augmente quand la température s’abaisse.
Rapport poudre/liquide : le temps de prise augmente avec la proportion de liquide.
Présence d’éléments susceptibles d’activer ou de retarder la réaction.
3.
1.
4.
1 - Eléments activant la réaction
Sels ionisables organiques et minéraux : le chlorure de magnésium, le acétate de sodium ou de zinc (incorporés à la poudre ou au liquide), les radicaux acides (acide acétique), l’acide benzoïque.
Ces éléments peuvent appartenir à la série aliphatique ou à la série aromatique, moins active. Selon le type utilisé, la réaction de durcissement peut être ramenée à quelques minutes.
3.
1.
4.
2 - Eléments ralentissant la réaction
Ce sont des produits hydrophobes : huiles minérales ou végétales synthétiques et du colophane.
Les carbonates de zinc ZnCO
3 et des hydroxydes de zinc Zn(OH)
2, dont la formation est due au conditionnement non hermétique de la poudre, peuvent intervenir. Ces substances ressemblent à l’oxyde de zinc (blanches).
Elles peuvent être détruites par chauffage (600°C) :
6/13